主要区别
S轨道和P轨道的主要区别在于S轨道是原子的球形轨道,而P轨道是原子中的哑铃形轨道。
s轨道(s orbital) vs. p轨道(p orbital)
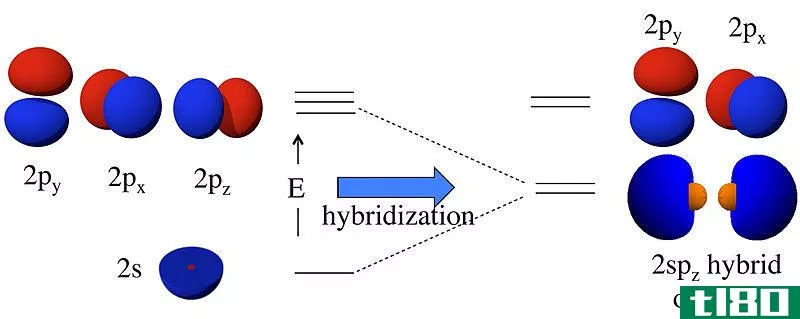
在s轨道,能级很低,而在p轨道,能级很高。S轨道有零个角节点;另一方面,p轨道有一个不同的角节点。在s轨道上,它能容纳的最多两个电子在它的轨道上,而在p轨道上,它能容纳六个电子在它的轨道上。S轨道定义为原子中的球形轨道,而p轨道定义为原子中的哑铃形轨道。
在s轨道中,没有子壳层或子轨道,而在p轨道中,有三个子轨道。在s轨道上,角动量为零;另一方面,在p轨道上,角动量为1。在s轨道上,没有多少个瓣,而在p轨道上,叶数很少。电子的填充首先填充在s轨道上,而电子填充在p轨道上第二。
由于电离能高,很难从s轨道上移除电子,而由于电离能较低,p轨道上的电子很容易丢失。S轨道在原子核附近,而p轨道则远离原子核。在原子核的轨道上,只有两个电子绕着原子核旋转。
比较图
什么是s轨道(s orbital)?
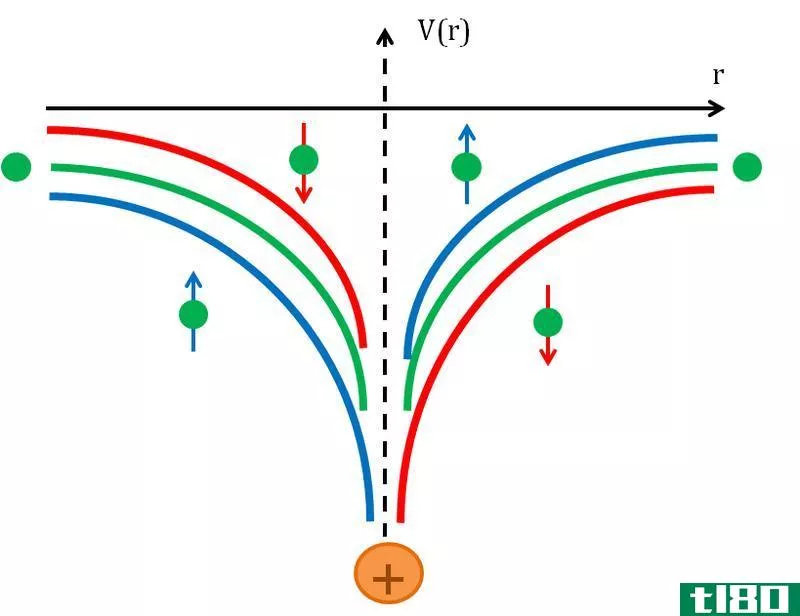
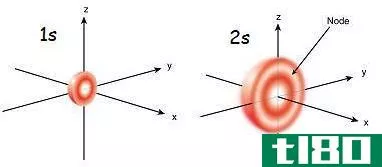
它被定义为原子中的球形轨道。它存在于原子核的上方。S轨道的电子持有能量很低。它只能容纳2个电子。这两个电子以球形绕着原子核旋转。我们需要很高的能量来移除这两个电子。在杂交的情况下,这个壳会从头到脚地形成不同形状的分子。
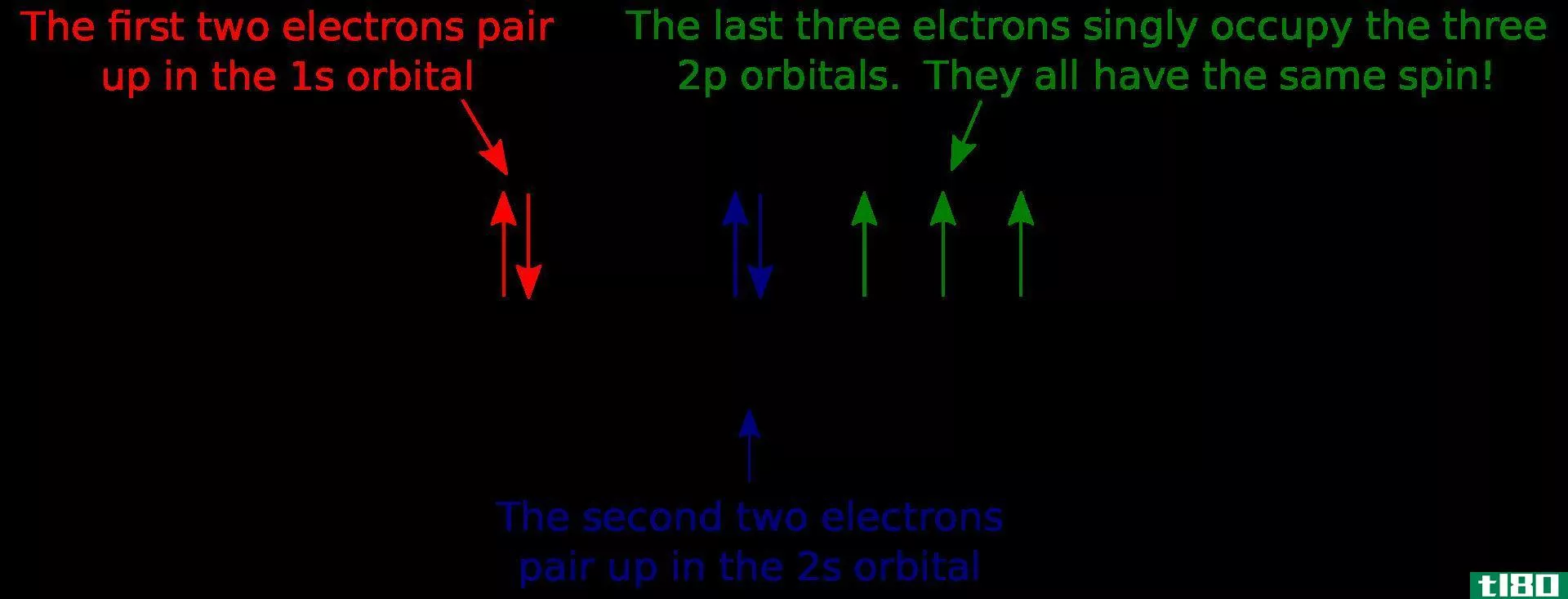
电子不断地旋转进入轨道。壳层的填充是从s轨道开始的。S轨道由于其球形,角动量为零。S轨道由于其球形,角节点为零。它是每个原子的第一个轨道。在s轨道上,波瓣数为零。例如,在氢中,电子组态是1s加1个电子,它是一个不完全轨道。
但是在氦中,有2个电子,这就是完整的轨道。s轨道位于原子核附近,因此它被原子核电荷强烈吸引。原子在这个轨道上是稳定的。
什么是p轨道(p orbital)?
它被定义为原子中哑铃形的原子轨道。它存在于原子的s轨道之上。它比s轨道更有能量。它在一个原子的轨道上有六个电子。我们不需要大量的能量来移除这些电子。在原子中,p轨道电子首先参与成键。通过它们的结合,释放出的能量非常少。
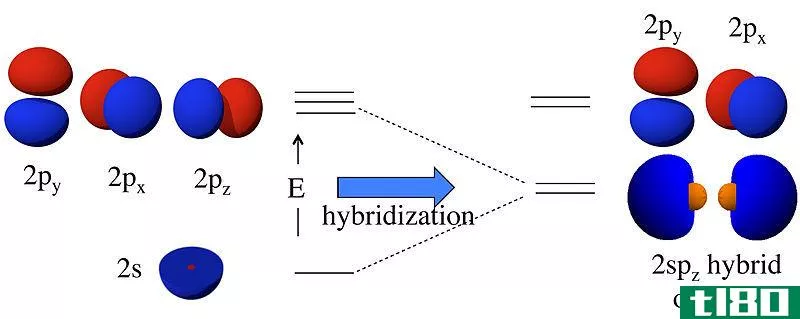
在杂交条件下,其中一个p子轨道形成头对头重叠,另外两个p子轨道形成侧向重叠。P轨道有几个不同的角节点,因为它存在于3个轴上。p轨道上的最大电子数是6个电子。在p轨道中有三个子轨道,每个子轨道包含2个电子。
p轨道的角动量是一个,因为它的结构不同。它在x,y,z三个轴上定向,例如在碳原子中,最大电子数为6,分布在1s2s2p中,p轨道是不完全填充的。
主要区别
- S轨道定义为原子中的球形轨道,而p轨道是原子中的哑铃形轨道。
- S轨道是低能轨道;另一方面,p轨道是高能轨道。
- S轨道在其壳层中最多包含2个电子;相反,p轨道在其轨道中最多包含6个电子。
- 在s轨道中,电子以球形旋转;在p轨道中,电子以哑铃形轨道旋转。
- 在s轨道上,最大的子轨道数是1,而在p轨道上,最大的轨道数是3。
- 在s轨道中,波瓣的数目为零,而在p轨道中,波瓣的数目很少。
结论
以上讨论得出结论:原子中的s轨道是具有较少性质的球形轨道,而原子中的p轨道是具有特殊性质的哑铃形轨道。