原子轨道(atomic orbital)和分子轨道(molecular orbital)的区别
原子轨道
原子轨道是围绕原子核的区域,在那里电子被发现的概率很高。轨道允许原子通过更高轨道上的电子共享或交换与其他原子结合形成分子。它们由不同的能级组成,包含最多电子的轨道取决于原子吸收的能量大小。
轨道与海森堡测不准原理

由于量子力学的复杂性,不可能同时知道亚原子粒子(如电子)的动量和位置。物理学家维尔纳·海森堡(Werner Heisenberg)证实了这一点,并以此命名该原理。由于海森堡的测不准原理,我们无法确切地知道一个电子在哪里,或者它在未来相对于它被电磁力束缚的原子核的位置。只有知道电子在原子中最可能的位置才有可能。在靠近原子核的某些区域,电子被定位的概率很高。这些区域称为轨道。
轨道内的能态
所有的电子都有能量,如果没有能量,它们就会坍缩成原子核。离原子核较远的电子比离原子核较近的电子具有更高的能量。电子吸收辐射时能量增加。由于电磁辐射的不连续性,当电子吸收更多能量时,电子不会平稳地从原子核移动得更远,相反,当能量增加时,电子会从一个离散能级跳到下一个能级。每个能级都与原子核周围的某个区域有关。当一个原子跃迁到一个更高的能量区域时,它被称为被激发。
轨道类型
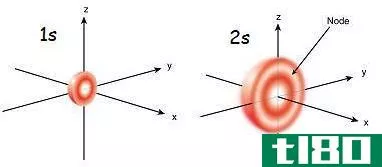
除了轨道之间的不同能级外,还有与不同能级相关的不同形状的轨道。最基本的轨道是s轨道,它占据了原子核周围一个大致呈球形的区域。在s轨道内有不同的能级,标记为1s、2s、3s等。一个原子的s轨道的能量大多低于其他轨道,尽管不是所有轨道。另一个轨道是p轨道。这个轨道的形状是两个分开的球体,它们束缚在原子核上。它们也缺乏最低的能量水平。有1s能级,但没有1p能级。
在p轨道之外是d轨道,其概率区域类似于四个在原子核处形成交叉或x形会合的裂片。这些轨道通常比s或p轨道的能量更高,尽管情况并非总是如此。例如,4s实际上比3d能量更高。能量最高、最难理解的轨道是f轨道,它有着相对奇异的、许多波瓣形状。
原子轨道与分子的形成
当一个原子的电子和另一个原子的原子核之间的吸引力比两个原子的原子核相互排斥的吸引力更强烈时,两个原子就会结合在一起。最终,一个原子将失去一个电子,变得更带正电,并形成离子键,或者它们最终将共享电子,在这种情况下,电子的密度云或波函数重叠。但要实现这一点,必须在轨道能级中留出空间,以便引入新的电子。这就是通过占据原子空能级的新电子来共享或交换电子的方式。
分子轨道
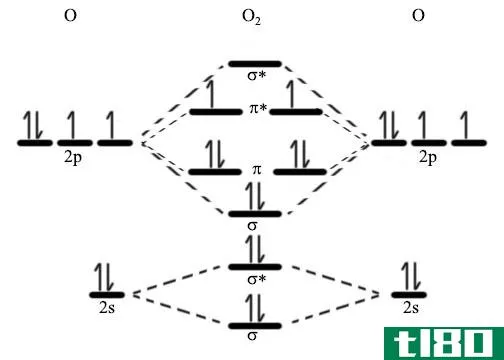
当原子结合形成分子时,束缚原子核周围形成新的轨道。分子轨道是在分子中可能发现高能电子的区域。
分子轨道的类型
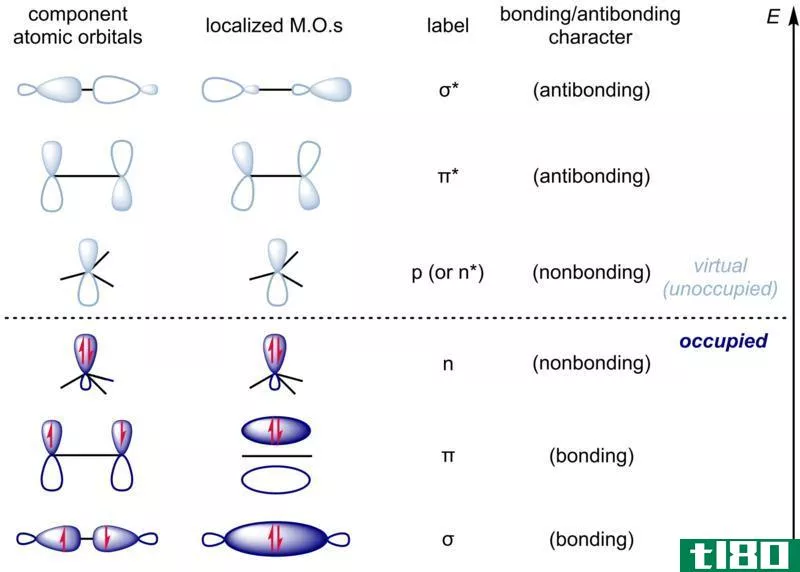
除了不同形状的轨道外,分子轨道还包括使原子更稳定或更不稳定的轨道。成键分子轨道是电子在单个原子核之间花费大部分时间的轨道。成键分子轨道促进成键并产生稳定的分子。反键分子轨道是电子大部分时间远离键合核之间空间的轨道。这些会产生不稳定的分子。
在双原子分子中,成键分子轨道的能量低于成键原子的1s轨道,而反键分子轨道的能量高于1s轨道。如果成键轨道中的电子比反成键轨道中的电子多,分子将是稳定的。如果反成键轨道中有更多的电子,或者如果成键轨道和反成键轨道中的电子数相同,它们将不稳定。
如果一个双原子分子中的结合原子的成键轨道中的电子比1s轨道中的电子多,这基本上意味着原子作为分子存在所需的能量比作为独立原子存在所需的能量少,物质总是倾向于低能量的选择。反键轨道中的电子越多,意味着原子分开存在所需的能量就越少。
分子轨道形状
分子轨道也有不同的形状。一个是s轨道。在这个轨道内,电子最有可能沿着连接两个原子核的轴被发现。成键轨道。抗粘结等效物表示为s*。p轨道是电子都聚集在前面提到的轴上方或下方的轨道。
原子轨道(atomic orbitals)和分子轨道(molecular orbitals)的相似点
原子和分子轨道都是原子核周围最有可能出现电子的区域。它们也有许多形状,由不同的能级组成,其中一些轨道的能级高于其他轨道的能级。
原子轨道与分子轨道的区别
虽然分子轨道和原子轨道相似,但它们也有显著的区别
- 原子轨道围绕着单个原子核,而分子轨道围绕着被电磁力结合在一起形成分子的原子核团。
- 原子轨道内的电子构型不会影响原子的稳定性,而分子轨道内的电子构型会影响分子的稳定性和存在性。
原子轨道与分子轨道

总结
原子轨道是原子核周围最有可能发现电子的区域。它们可以是由多个能级组成的不同形状。高能电子位于离原子核更远的轨道上。分子轨道是分子周围最有可能发现电子的区域。除了由不同的形状和能级组成外,还有使分子更稳定的键轨道和使分子更不稳定的反键轨道。当原子轨道发生在单个原子核周围时,分子轨道发生在分子内的一组原子核周围。此外,原子轨道对原子的稳定性没有影响,而分子轨道可以使分子稳定或不稳定,这取决于键轨道或反键轨道中有多少电子。
- 发表于 2021-11-16 13:29
- 阅读 ( 323 )
- 分类:化学
你可能感兴趣的文章
px py公司(px py)和pz轨道(pz orbitals)的区别
...个轨道有两个半球,呈哑铃状。量子数是一组有助于命名原子轨道的数字。这个系统给一个特定的原子轨道起了一个独特的名字。 图1:不同的p轨道及其方向 量子数: 主量子数(n)描述了电子壳层。例:n=1,2,3… 方位角量...
- 发布于 2020-10-14 02:27
- 阅读 ( 936 )
分子轨道理论(molecular orbital theory)和杂交理论(hybridization theory)的区别
...-分子轨道理论与杂交理论 5. 摘要 什么是分子轨道理论(molecular orbital theory)? 分子轨道理论是用量子力学描述分子电子结构的技术。这是解释分子中化学键的最有效的方法。让我们详细讨论一下这个理论。 首先,我们需要知道...
- 发布于 2020-10-15 22:50
- 阅读 ( 833 )
反键合(antibonding)和非键合(nonbonding)的区别
...示为σ*。 什么是非键合(nonbonding)? Nonbonding orbital is the molecular orbital in which addition or removal of electr*** neither increases or decreases the bond order between atoms. We often designate this orbital by “n”. These orbitals resemble the lone electron pairs in Lewis struc...
- 发布于 2020-10-16 03:12
- 阅读 ( 1262 )
混合的(hybrid)和简并轨道(degenerate orbitals)的区别
...个或多个轨道混合形成的新轨道,而退化轨道最初存在于原子中。 正如它的名字所暗示的,混合轨道是两个或更多轨道的混合。虽然简并轨道的名称看起来是一样的,但它们不是新形成的轨道——它们已经存在于原子中。此外...
- 发布于 2020-10-16 17:47
- 阅读 ( 892 )
纯净的(pure)和杂化轨道(hybrid orbitals)的区别
纯轨道和杂化轨道的关键区别在于,纯轨道是原始原子轨道,而杂化轨道是由两个或多个原子轨道混合而成。 在简单分子的化学键形成过程中,我们可以简单地考虑原子轨道的重叠。但是如果我们要讨论复杂分子中的化学键...
- 发布于 2020-10-17 13:43
- 阅读 ( 551 )
轨道(orbit)和轨道(orbital)的区别
...是一条围绕中心点有固定路径的环形路径,而轨道是围绕原子核的不确定区域。 虽然术语“轨道”和“轨道”听起来相似,但这是两个不同的术语。轨道一词主要与行星有关,而轨道一词则与原子有关。另外,确定一个不确定...
- 发布于 2020-10-23 03:43
- 阅读 ( 444 )
分子轨道(molecular orbital)和原子轨道(atomic orbital)的区别
...子轨道和原子轨道的表格形式 5. 摘要 什么是分子轨道(a molecular orbital)? 原子结合在一起形成分子。当两个原子靠得更近形成一个分子时,原子轨道重叠并结合成分子轨道。新形成的分子轨道数等于组合原子轨道数。此外,分子...
- 发布于 2020-10-24 07:58
- 阅读 ( 555 )
1秒(1s)和2s轨道(2s orbital)的区别
1秒(1s)和2s轨道(2s orbital)的区别 原子是物质的最小单位。换句话说,所有物质都是由原子构成的。原子由亚原子粒子组成,主要是质子、电子和中子。质子和电子使原子核位于原子中心。但是电子被定位在位于原子核外的轨道...
- 发布于 2020-10-25 04:49
- 阅读 ( 575 )
结合(bonding)和反键分子轨道(antibonding molecular orbitals)的区别
...电子占据同一个分子轨道。 什么是键合分子轨道(bonding molecular orbitals)? 键合分子轨道是由原子轨道通过原子轨道的同相结合而形成的。它增加了键合原子之间的电子密度。它们的能量低于原子轨道。电子首先被填充到键合分子...
- 发布于 2020-10-26 19:13
- 阅读 ( 637 )
分子轨道理论(molecular orbital theory)和价键理论(valence bond theory)的区别
...理论与价键理论的表格形式 5. 摘要 什么是分子轨道理论(molecular orbital theory)? 在分子中,电子位于分子轨道上,但它们的形状不同,它们与不止一个原子核有关。分子轨道理论是基于分子轨道对分子的描述。 通过原子轨道的线...
- 发布于 2020-11-03 20:05
- 阅读 ( 450 )