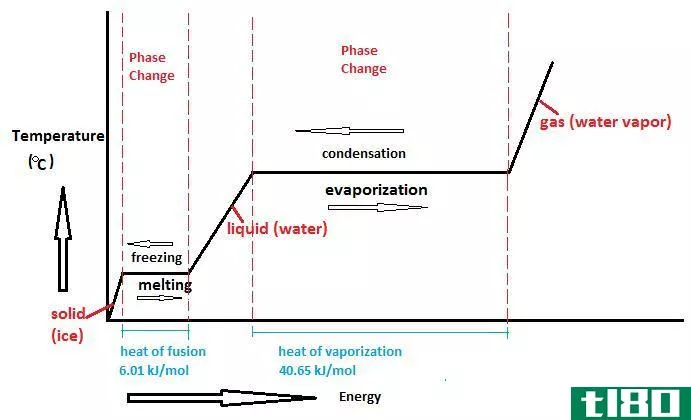
如何计算蒸气压(calculate vapor pressure)
方法1方法1的3:使用克劳修斯-克莱佩伦方程
- 1写出克劳修斯-克拉佩伦方程。用于计算蒸汽压随时间变化的公式被称为克劳修斯-克拉佩伦方程(以物理学家鲁道夫-克劳修斯和伯努瓦-保罗-埃米尔-克拉佩伦命名)。这是你用来解决物理和化学课中最常见的各种蒸汽压力问题的公式。该公式看起来像这样:ln(P1/P2) = (ΔHvap/R)((1/T2) - (1/T1))。在这个公式中,变量指的是:ΔHvap。液体的汽化焓。这通常可以在化学教科书后面的表格中找到。R:实际气体常数,或8.314 J/(K × Mol)。T2:要找到蒸气压的温度(或最终温度)。
- 2填入你知道的变量。克劳修斯-克拉佩伦方程看起来很棘手,因为它有这么多不同的变量,但实际上当你有正确的信息时,它并不难。最基本的蒸汽压力问题会给你两个温度值和一个压力值,或者两个压力值和一个温度值--一旦你有了这些,解决问题就小菜一碟了。我们的问题是:393K时的蒸汽压是多少?我们有两个温度值和一个压力,所以我们可以用克劳修斯-克拉佩伦方程求出另一个压力值。插入我们的变量,我们得到ln(1/P2) = (ΔHvap/R)((1/393) - (1/295))。注意,对于克劳修斯-克拉佩伦方程,你必须始终使用开尔文温度值。你可以使用任何压力值,只要它们对P1和P2都是一样的。
- 3插入你的常数。克劳修斯-克拉佩伦方程包含两个常数。R和ΔHvap。R总是等于8.314 J/(K × Mol)。然而,ΔHvap(汽化焓)取决于你要研究的物质的蒸气压。如上所述,你通常可以在化学或物理教科书的后面找到大量物质的ΔHvap值,或者在网上找到。在我们的例子中,假设我们的液体是纯水。如果我们看一下ΔHvap值的表格,我们可以发现ΔHvap大约是40.65 kJ/mol。由于我们的H值使用的是焦耳,而不是千焦耳,我们可以将其转换为40,650焦耳/摩尔。将我们的常数插入我们的方程式,我们得到ln(1/P2)=(40,650/8.314)((1/393)-(1/295))。
- 4.解方程。一旦你把方程中的所有变量都插进去,除了你要解的那个变量,就按照普通代数的规则继续解方程。解我们的方程(ln(1/P2) = (40,650/8.314)((1/393) - (1/295))的唯一困难部分是处理自然对数(ln)的问题。)要取消自然对数,只需将方程两边作为数学常数e的指数,换句话说,ln(x)=2 → eln(x)=e2 → x=e2。现在,让我们解决我们的方程:ln(1/P2) = (40,650/8.314)((1/393) - (1/295))ln(1/P2) = (4,889.34)(-0.00084)(1/P2) = e(-4.107)1/P2 = 0.0165P2 = 0.0165-1 = 60.76 atm。这是有道理的--在一个密封的容器中,将温度提高近100度(超过水的沸点近20度)会产生大量蒸汽,大大增加压力
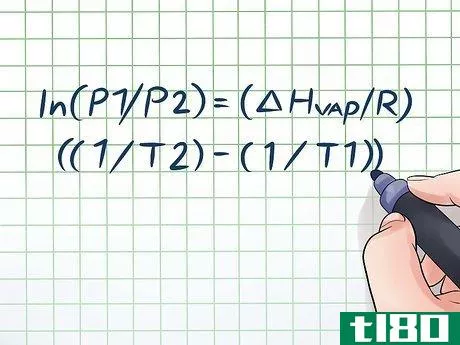


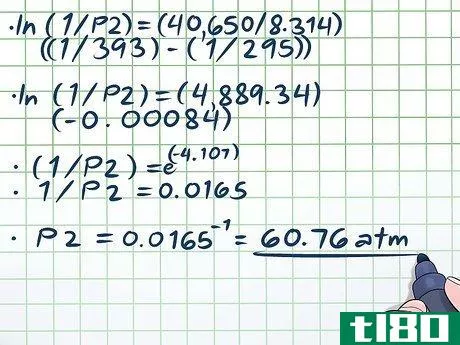
方法2 3的方法2:用溶解的溶液寻找蒸气压力
- 1写出劳尔特定律。在现实生活中,我们很少与单一的纯液体打交道--通常,我们处理的液体是几种不同成分物质的混合物。这些混合物中最常见的一些是通过将少量被称为溶质的某种化学物质溶解在大量被称为溶剂的化学物质中而形成的溶液。在这些情况下,了解一个叫做拉乌尔定律(以物理学家弗朗索瓦-马里-拉乌尔命名)的方程式是很有用的,这个方程式看起来像这样。Psolution=PsolventXsolvent。在这个公式中,变量指的是;Psolution。整个溶液的蒸汽压力(所有组成部分的总和);溶剂。溶剂的蒸汽压Xsolvent。如果你不知道 "摩尔分数 "等术语,请不要担心--我们将在接下来的几个步骤中解释这些术语。
- 2识别溶液中的溶剂和溶质。在计算混合液体的蒸气压之前,你需要确定你正在使用的物质。作为提醒,当溶质溶解在溶剂中时,就形成了溶液--溶解的化学物质总是溶质,而进行溶解的化学物质总是溶剂。让我们在本节中通过一个简单的例子来说明我们正在讨论的概念。就我们的例子而言,假设我们想找到单糖浆的蒸气压。传统上,单糖浆是一份糖溶解在一份水中,所以我们说糖是我们的溶质,水是我们的溶剂。请注意,蔗糖(食糖)的化学式是C12H22O11。这一点很快就会变得很重要。
- 3找出溶液的温度。正如我们在上面的克劳修斯-克拉佩伦部分所看到的,液体的温度会影响其蒸汽压。一般来说,温度越高,蒸汽压就越大--随着温度的升高,更多的液体将蒸发并形成蒸汽,增加容器中的压力。
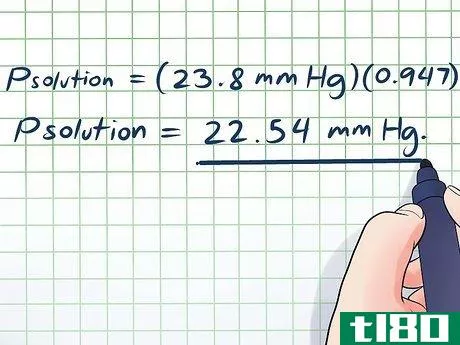
- 4找出溶剂的蒸气压。化学参考资料通常有许多常见物质和化合物的蒸汽压值,但这些压力值通常只适用于物质在25 C/298 K或沸点时。如果你的溶液处于这些温度之一,你可以使用参考值,但如果不是,你需要找到其当前温度下的蒸气压。克劳修斯-克拉佩伦在这里可以提供帮助--使用参考蒸气压和298 K(25 C)分别作为P1和T1。在我们的例子中,我们的混合物处于25 C,所以我们可以使用我们的简易参考表。我们发现,水在25摄氏度时的蒸汽压为23.8毫米HG
- 5找出你的溶剂的摩尔分数。在解决问题之前,我们需要做的最后一件事是找出溶剂的摩尔分数。找出摩尔分数很容易:只要把你的成分换算成摩尔,然后找出每种成分在物质总摩尔数中所占的百分比。换句话说,每种成分的摩尔分数等于(成分的摩尔数)/(物质的总摩尔数)。比方说,我们的单糖浆配方使用了1升水和1升蔗糖(糖)。要做到这一点,我们将找到每一种物质的质量,然后用物质的摩尔质量来换算成摩尔。约1,056.7克摩尔(水):1,000克×1mol/18.015克=55.51摩尔摩尔(蔗糖):1,056.7克×1mol/342.2965克=3.08摩尔(注意,你可以从其化学式C12H22O11找到蔗糖的摩尔质量。)总摩尔:55.51+3.08=58.59摩尔水的摩尔分数。55.51/58.59 = 0.947
- 6解决。最后,我们拥有了解决劳尔特定律方程所需的一切。这一部分出乎意料地简单:只要把你的数值插入本节开头的简化拉乌尔特定律方程中的变量(Psolution = PsolventXsolvent)。这是有道理的--在摩尔术语中,只有少量的糖溶解在大量的水中(尽管在现实世界中,两种成分的体积相同),所以蒸汽压力只会略有下降。
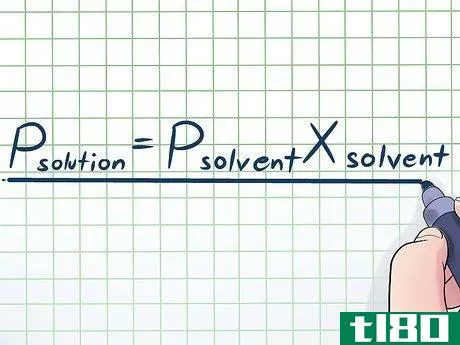



方法3 方法3:在特殊情况下寻找蒸汽压力
- 1要注意标准温度和压力条件。科学家们经常使用一组温度和压力值作为一种方便的 "默认值"。这些值被称为标准温度和压力(或简称STP)。蒸汽压力问题经常参考STP条件,所以记住这些数值是很方便的。STP值的定义如下。温度:273.15 K / 0 C / 32 FP压力:760 mm Hg / 1 atm / 101.325 kilopascals
- 2重新排列克劳修斯-克拉佩伦方程以寻找其他变量。在第1节的例子中,我们看到克劳修斯-克拉佩伦方程对寻找纯物质的蒸气压非常有用。然而,并不是每个问题都要求你找到P1或P2--许多问题会要求你找到一个温度值,甚至有时是一个ΔHvap值。幸运的是,在这些情况下,得到正确的答案只需重新排列方程,使你要解决的变量单独在等号的一边。例如,假设我们有一种未知的液体,在273K时的蒸汽压为25托,在325K时的蒸汽压为150托,我们想找到这种液体的汽化焓(ΔHvap)。我们可以这样求解:ln(P1/P2)=(ΔHvap/R)((1/T2)-(1/T1))(ln(P1/P2))/((1/T2)-(1/T1))=(ΔHvap/R)R ×(ln(P1/P2))/((1/T2)-(1/T1) = ΔHvap 现在,我们插入我们的数值:8.314 J/(K × Mol) × (-1.79)/(-0.00059) = ΔHvap8.314 J/(K × Mol) × 3,033.90 = ΔHvap = 25,223.83 J/mol
- 3计算溶质产生蒸汽时的蒸汽压。在我们上面的Raoult定律的例子中,我们的溶质,糖,在正常温度下不会自己产生任何蒸汽(想想看,你最后一次看到一碗糖在你的台面上蒸发是什么时候?)然而,当你的溶质蒸发时,这将影响你的蒸气压。我们通过使用Raoult定律方程的修改版来说明这一点。Psolution = Σ(PcomponentXcomponent) 西格玛(Σ)符号意味着我们只需要将所有不同成分的蒸汽压相加就可以找到答案。溶液的总体积是120毫升(mL);60毫升的苯和60毫升的甲苯。溶液的温度是25摄氏度,在25摄氏度时这些化学品的蒸气压是:苯95.1毫米汞柱,甲苯28.4毫米汞柱。考虑到这些数值,求出该溶液的蒸气压。我们可以使用这两种化学品的标准密度、摩尔质量和蒸汽压值来进行计算:质量(苯):60毫升=0.060升&乘以876.50千克/1,000升=0.053千克=53克质量(甲苯):0.060升&乘以866.90千克/1,000升=0。052公斤=52克摩尔(苯):53克×1摩尔/78.11克=0.679摩尔摩尔(甲苯):52克×1摩尔/92.14克=0.564摩尔总摩尔:0.679+0.564=1.24摩尔分数(苯):0.679/1.243=0.546摩尔分数(甲苯):0.564/1.243=0.454溶解。溶液=PbenzeneXbenzene+PtolueneXtoluene溶液=(95.1毫米汞柱)(0.546)+(28.4毫米汞柱)(0.454)溶液=51.92毫米汞柱+12.89毫米汞柱 =64.81毫米汞柱



- 要使用上述克劳修斯-克拉佩伦方程,温度必须以开尔文(表示为K)测量。如果你有摄氏温度,那么你需要用以下公式进行转换。Tk = 273 + Tc
- 上述方法之所以有效,是因为能量与提供的热量成正比。液体的温度是蒸汽压力所依赖的唯一环境因素。
- 发表于 2022-03-11 15:47
- 阅读 ( 128 )
- 分类:教育
你可能感兴趣的文章
真空压力(vacuum pressure)和蒸汽压(vapour pressure)的区别
...力与蒸汽压力的表格形式 6. 摘要 什么是真空压力(vacuum pressure)? 真空压力是真空中的压力。换句话说,如果我们在一个封闭的容器内产生真空,那么这个容器的真空压力就是容器内外的绝对压力之差,当容器外部的压力大于容...
- 发布于 2020-10-17 12:31
- 阅读 ( 438 )
金属卤化物(metal halide)和多蒸汽(multi vapor)的区别
金属卤化物灯或多蒸气灯含有多种气体成分的混合物,包括汞和一些金属卤化物。让我们讨论一下这些灯的更多细节,看看金属卤化物灯和多蒸气灯之间是否有什么区别。 目录 1. 什么是金属卤化物 2. 什么是多蒸汽 3. 金属卤...
- 发布于 2020-10-18 00:24
- 阅读 ( 220 )
蒸汽(steam)和水蒸气(vapor)的区别
...。 我们使用术语“蒸汽”作为一个共同的名称来命名水蒸气。任何其他物质的气态都是“蒸汽”。因此,术语的使用是蒸汽和蒸汽之间的关键区别。除此之外,我们将在本文中描述蒸汽和蒸汽之间的更多区别。 目录 1. 概述和主...
- 发布于 2020-10-21 16:24
- 阅读 ( 286 )
融合(fusion)和汽化(vaporization)的区别
...是液体变成蒸汽时焓的变化,这是压力的函数。 图02:水蒸气在水循环过程中凝结形成云 蒸发主要有两种方式: 蒸发 蒸发发生在液体表面。它发生在温度低于相同压力下液体的沸点。此外,只有当分蒸气压小于平衡蒸气压时才...
- 发布于 2020-10-23 03:09
- 阅读 ( 338 )
平均自由程(mean free path)和压力(pressure)的区别
平均自由程(mean free path)和压力(pressure)的区别 平均自由程是一个运动的分子与其他分子碰撞时所经过的平均距离。因此,它是用长度测量单位来测量的。平均自由程是用分子的平均速度来确定的,而碰撞频率是因为用距离来...
- 发布于 2020-10-24 02:14
- 阅读 ( 763 )
蒸发(evaporation)和汽化(vaporization)的区别
...液体的沸腾温度。 图02:沸水 为了使液体沸腾,液体的蒸气压应等于液体周围的外部压力。这意味着液体表面的分子应具有足以克服液体分子之间分子间作用力的动能;因此,这些分子可以通过转变为气相离开液体。 蒸发(evapor...
- 发布于 2020-10-29 16:49
- 阅读 ( 990 )
气体(gas)和水蒸气(vapor)的区别
...子是乙醇与其蒸汽之间的平衡。下图显示了这两个阶段是如何相关的。 图02:乙醇和水的汽液平衡混合物 气体(gas)和水蒸气(vapor)的区别 气体与蒸汽 气体只能存在于一个热力学相。 蒸汽可以与其液相共存。 物理状...
- 发布于 2020-11-04 10:45
- 阅读 ( 701 )
气体(gas)和水蒸气(vapor)的区别
...以气体的形式形成的,但它被认为是物质的第四态。 “蒸气”不是物质的一种状态,而是在低于临界点的温度下处于气相的物质。随着温度的恒定和压力的增加,蒸汽可以变回液体或固体。 蒸汽是沸腾和蒸发的结果。它负责云...
- 发布于 2021-06-23 13:29
- 阅读 ( 253 )
蒸发(evaporation)和汽化(vaporization)的区别
...蒸发。 汽化包括从液体到气体的状态变化,而不管温度如何,也就是说,它包括沸点以下以及沸点以下发生的相变(注意,我们不能谈论沸点以上的汽化)。直到所有的液体都变了相,温度才升到沸点以上。 压力 当蒸汽压低于...
- 发布于 2021-06-27 03:25
- 阅读 ( 266 )
分压(partial pressure)和蒸汽压(vapor pressure)的区别
主压差分压(main difference partial pressure) vs. 蒸汽压(vapor pressure) 压力是一种物质施加在另一种物质单位面积上的力。分压和蒸气压是与物质有关的两种压力。分压和蒸气压之间的主要区别在于,分压是气体混合物中单个气...
- 发布于 2021-06-28 18:52
- 阅读 ( 512 )