如何确定经验公式(determine an empirical formula)
方法1方法1/3:方法1:使用重量百分比
- 1查看数据。如果给你一种未知化合物的元素组成以百分比而不是克为单位,你应该假设所涉及的物质正好有100.0克。如果上述情况属实,则应遵循以下说明。如果您得到了未知物质的元素组成(单位:克),请参阅“使用重量(单位:克)”一节示例:确定由29.3%钠(钠)、41.1%硫(硫)和29.6%氧(氧)制成的化合物的经验公式。
- 2确定每个元素的克数。基于存在100克未知物质的假设,您可以确定每个元素的克数等于问题中提到的每个元素的百分比值。例如:对于100 g未知物质,有29.3 g Na、41.1 g S和29.6 g O。
- 3将每个元素的质量换算为摩尔。成分中每种元素的质量,目前以克表示,需要换算成摩尔。为此,每种质量必须乘以其各自原子量的摩尔比。简单地说,你需要用每个质量除以该元素的原子量。还请注意,此计算中使用的原子量应至少包括四个有效数字。示例:对于含有29.3 g Na、41.1 g S和29.6 g O的化合物:29.3 g Na*(1 mol S/22.99 g Na)=1.274 mol Na41.1 g S*(1 mol S/32.06 g S)=1.282 mol S29.6 g O*(1 mol O/16.00 g O)=1.850 mol O
- 4用存在的最小摩尔数划分每个摩尔值。你需要对化合物中的元素进行化学计量比较,这基本上意味着你需要计算一种元素相对于化合物中其他元素的含量。为此,将每个摩尔数除以存在的最小摩尔数。示例:化合物中存在的最小摩尔数为1.274摩尔(钠的摩尔数)。1.274 mol Na/1.274 mol=1.000 Na1.282 mol S/1.274 mol=1.006 S1.850 mol O/1.274 mol=1.452 O
- 5将比值乘以以找到近似整数。每个元素的摩尔数可能不等于整数。对于与整数相差十分之一以内的小值,这不会出现问题。但是,一旦有一个超出此值的多余值,则应根据需要将比值相乘,以使该值达到整数。如果一个元素的值接近0.5,则将每个元素乘以2。类似地,如果一个元素的值接近0.25,则将每个元素乘以4。示例:由于存在的氧气量(O)接近1.5,因此需要将每个值乘以“2”,使氧气的比率接近整数。1.000 Na*2=2.000 Na1.006 S*2=2.012 S1.452 O*2=2.904 O
- 6将数值四舍五入到最接近的整数。即使在最后一步之后,每个元素的摩尔数也可能不是精确的整数。由于经验公式中不使用小数,因此需要将每个值四舍五入到最接近的整数。示例:对于上一步中确定的比率:2.000 Na可写为2 Na。2.012秒可四舍五入为2秒。2.904秒可四舍五入为3秒。
- 7写下你的最终答案。将元素比率转换为用于经验公式的标准格式。对于大于1的所有量,每个元素的分子量应在其各自元素符号旁边的下标中表示。示例:对于2份Na、2份S和3份O的化合物,经验公式应写成:Na2S2O3




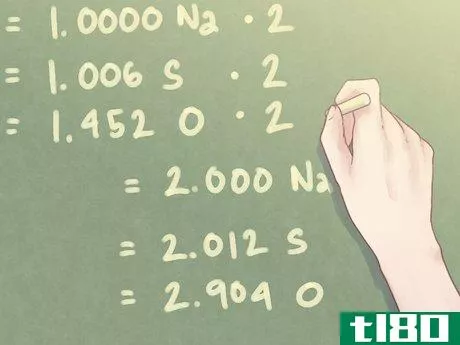
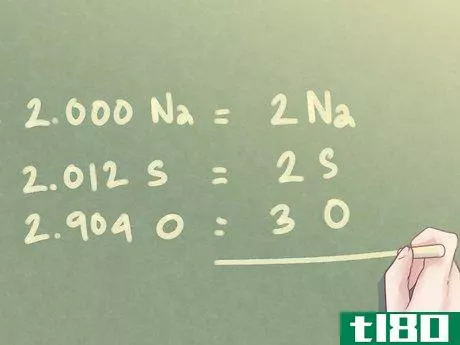
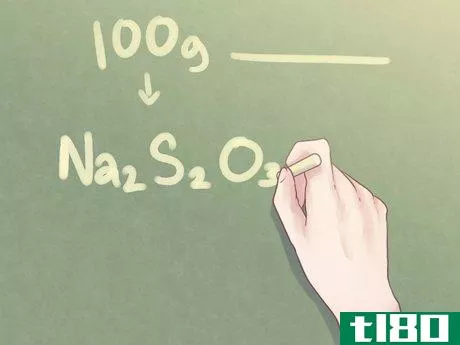
方法2方法2/3:方法2:使用重量(克)
- 1考虑克数。如果给您提供了未知物质的元素组成(单位:克),您需要按照以下说明进行操作。另一方面,如果给你的成分是百分比而不是克,请参阅“使用重量百分比”的说明示例:确定由8.5 g Fe(铁)和3.8 g O(氧)制成的未知物质的经验公式
- 2将每个元素的质量换算成摩尔。要确定化合物中元素的分子比,需要将每种元素的量从克转换为摩尔。通过将每种元素的质量(单位:克)除以元素各自的原子量来实现。从更技术的角度来看,你实际上是用克的质量乘以每原子量的摩尔比。请注意,原子量应四舍五入到四个重要位置,以在计算中保持一定程度的准确性。示例:当有8.5 g Fe和3.8 g O时:8.5 g Fe*(1 mol Fe/55.85 g Fe)=0.152 mol Fe3.8 g O*(1 mol O/16.00 g O)=0.238 mol O
- 3用最小的计算数字划分每个摩尔值。与化合物中的其他元素相比,确定每种元素的含量。为了计算这个,你需要确定存在的最小摩尔数,并用每个摩尔数除以这个数。示例:对于该问题,存在的最小摩尔数为0.152摩尔(存在的铁、铁的量)。0.152 mol Fe/0.152 mol=1.000 Fe0.238 mol O/0.152 mol=1.566 O
- 4将比值乘以整数。通常,每种物质的摩尔数可能不等于整数。如果超出部分在十分之一以内,你可以简单地将其四舍五入。但是,对于超过此值的多余值,需要将每个值乘以一个数字,使比值更接近整数。例如,如果一个元素的过量值接近0.25,则将每个元素的量乘以4。如果一个元素的过量值接近0.5,则将每个元素的量乘以2。示例:由于氧的比值等于1.566,因此需要将这两个比值乘以2.1.000 Fe*2=2.000 Fe1.566 O*2=3.132 O
- 5将答案四舍五入到最接近的整数。一旦化合物中所有元素的比值大致在整数的十分之一以内,就可以将任何差值四舍五入到最接近的整数。示例:Fe的量可以写为2。O的数量可以四舍五入到3。
- 6写出最终答案。元素比率应以经验公式形式重写。每个比值应在其各自元素符号旁边的下标中指示,除非比值等于1。示例:对于2份Fe和3份O的化合物,经验公式为:Fe2O3

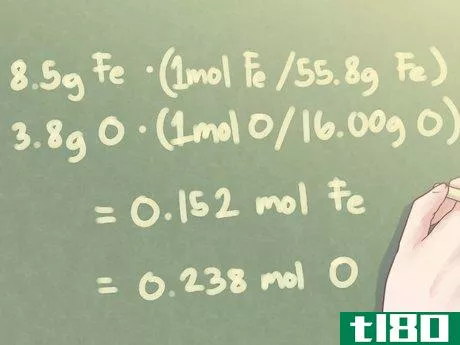
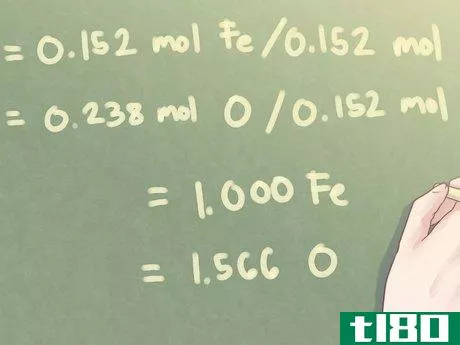
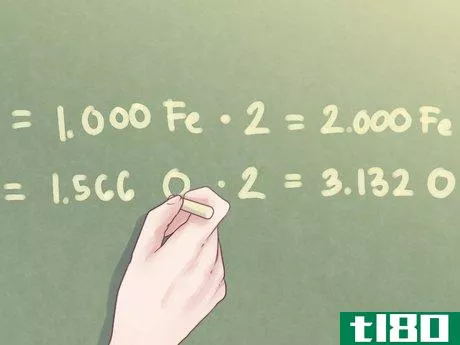
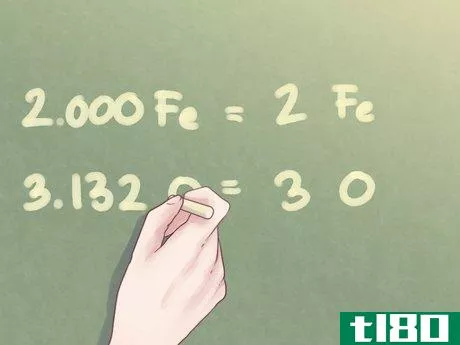

方法3方法3/3:方法三:使用分子式
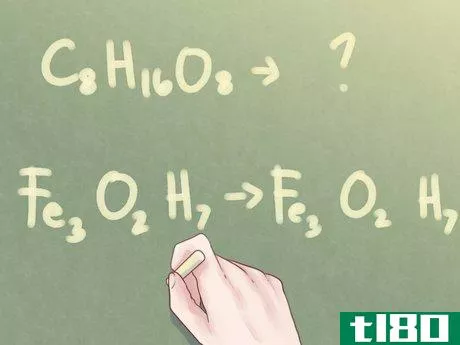
- 1确定是否可以减少下标。如果你有未知化合物的分子式,但被告知要通过其经验公式来识别该化合物,你需要确定该公式是否可以简化。查看存在的每个元素的下标。如果所有三个下标至少共享一个公因数(数字1除外),则需要采取更多步骤来确定化合物的经验公式。示例:C8H16O8另一方面,如果下标并非都共享一个共同因子,则分子式也是经验公式。示例:Fe3O2H7
- 2查找下标之间的最大公因数。在公式中写出每个下标的系数。确定哪个因素的价值最大。例如:对于C8H16O8,下标为“16”和“8”8的因子为:1、2、4、8。16的因子为:1、2、4、8、16。两个数字之间的最大公因数(GCF)为8。
- 3按最大公因数划分每个下标。要以最简单的形式获取每个下标,需要将公式中存在的所有下标除以刚刚找到的GCF。例如:对于C8H16O8:将8的下标除以8:8/8=1的GCF,将16的下标除以8:16/8=2的GCF
- 4写出最终答案。将原始下标替换为其简化值。在这样做的过程中,你已经从分子式中确定了化合物的经验式。请注意,1的值通常不会用下标表示。示例:C8H16O8=CH2O
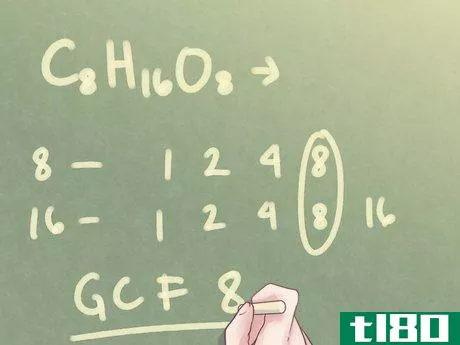
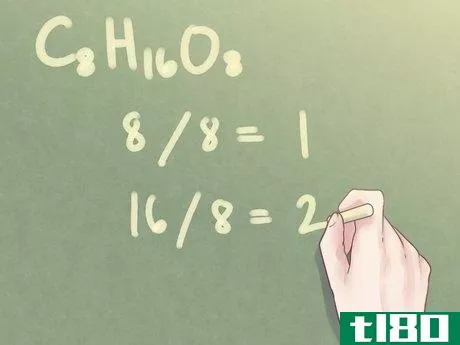
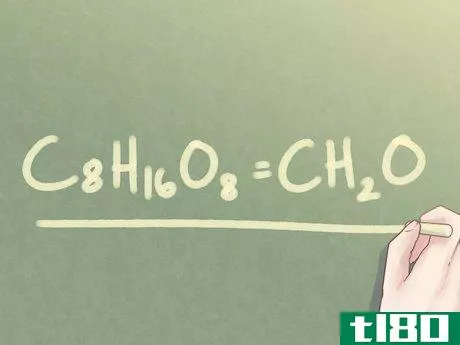
提示
- 发表于 2022-06-03 03:34
- 阅读 ( 31 )
- 分类:教育和通信
你可能感兴趣的文章
里德堡(rydberg)和巴尔默公式(balmer formula)的区别
...g与Balmer公式的表格形式 6. 摘要 什么是里德堡公式(rydberg formula)? 里德伯格公式是一个数学表达式,它预测了原子中电子激发所发射的光的波长。换句话说,这个公式可以找到当电子从激发态返回基态时发出的光子波长。里德伯...
- 发布于 2020-10-06 13:16
- 阅读 ( 719 )
公式单位质量(formula unit mass)和分子质量(molecular mass)的区别
公式单位质量(formula unit mass)和分子质量(molecular mass)的区别 一种化合物的式单位质量或式质量是该化合物经验式的质量。一种化合物的经验公式是一种化学式,它给出了化合物中不同原子之间的比例,以小整数表示。换句话...
- 发布于 2020-10-24 22:43
- 阅读 ( 908 )
经验主义的(empirical)和分子式(molecular formulas)的区别
...式与表格形式的分子式 5. 摘要 什么是经验公式(empirical formulas)? 经验公式是我们可以为分子写出的最简单形式的公式。它显示了分子中原子的类型,但并没有给出每个原子的实际数目。相反,它给出了分子中每个原子的最简单...
- 发布于 2020-11-05 19:13
- 阅读 ( 592 )
经验主义的(empirical)和分子式(molecular formula)的区别
在化学中,有许多不同的方式来表达一种化合物。你可以用它的俗名,如氯化钠或苯,也可以用化学式来表示。一个化学式比它的普通名称包含更多关于化合物的信息。化学式告诉你组成某种化合物的特定原子的信息。最常见的...
- 发布于 2021-06-22 11:56
- 阅读 ( 320 )
如何找到分子式(find the molecular formula)
...知道分子式-分子式的应用很重要 什么是分子式(molecular formula)? 分子式是化合物的化学式,它给出了化合物的原子类型和数量的信息。但它并没有给出这些原子结构排列的信息。它也没有给出这些原子之间存在的键的类型和数...
- 发布于 2021-06-28 19:33
- 阅读 ( 423 )
公式质量(formula mass)和分子质量(molecular mass)的区别
主要差异公式质量(main difference formula mass) vs. 分子质量(molecular mass) 分子式质量和分子质量是用来计算分子质量的两个术语。当考虑分子的经验公式时,质量公式给出了分子的质量。当考虑分子式时,分子质量给出了分子的质量...
- 发布于 2021-06-29 14:00
- 阅读 ( 612 )
分子的(molecular)和结构式(structural formula)的区别
... 主要差异分子(main difference molecular) vs. 结构式(structural formula) 化合物的分子式和结构式代表化合物中不同化学元素的原子。分子式给出了这些元素之间的比率。结构式给出了这些原子的相对位置。分子式与结构式的主要区别在...
- 发布于 2021-06-30 11:22
- 阅读 ( 384 )
经验主义的(empirical)和分子式(molecular formula)的区别
关键区别:化合物的经验公式显示了化合物中每种元素原子的最简单正整数比。一种化合物的分子式,也称为化学式,是一种表示每种元素在该特定化合物中所含原子量的方法。 公式在化学和物理中起着重要的作用。虽然这个...
- 发布于 2021-07-12 07:47
- 阅读 ( 188 )
如何使用单利公式(use the simple interest formula)
计算利息:本金、利率和时间已知 当您知道本金金额、利率和时间时,可以使用以下公式计算利息金额: i=prt 根据上述计算,您有4500美元可供投资(或借款),利率为9.5%,为期六年。 当本金、利率和时间已知时...
- 发布于 2021-09-05 11:59
- 阅读 ( 1047 )
什么是化学式?(a chemical formula?)
化学式是表示物质分子中原子数量和类型的表达式。原子的类型用元素符号表示。原子数由元素符号后的下标表示。 化学式示例 己烷分子中有6个C原子和14个H原子,其分子式为: C6H14 食盐或氯化钠的化学式为: NaCl ...
- 发布于 2021-09-19 07:07
- 阅读 ( 323 )