化学式のバランスの取り方
化学反応式は、化学反応を記号で書き表したものです(記号は元素を表す1文字以上)。左側が反応物、右側が生成物です。この2つは、左から右に走る矢印で結ばれており、反応が起きていることを象徴しています。質量保存の法則とは、化学反応では原子が生成も破壊もできないので、反応物中に存在する原子の数と生成物中に存在する原子の数が釣り合わなければならない、というものです。このガイドに従って、さまざまな方法で化学式のバランスをとる方法を学んでください...
方法1 方法2の1:従来のバランスを行う
- 1 与えられた方程式を書きなさい。この例では、C3H8 + O2 --> H2O + CO2 この反応は、プロパン(C3H8)が酸素の存在下で燃焼し、水と二酸化炭素を生成するときに起こります。
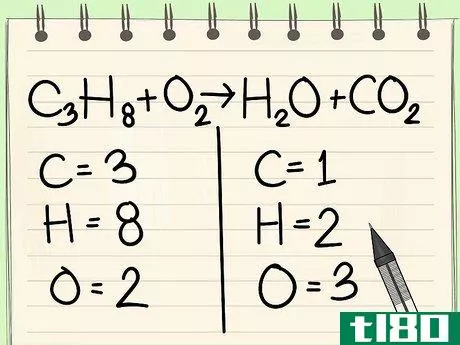
- 2 各元素の原子番号を書きなさい。これを式の各辺について行う。各原子の横の添え字を見て、式中の原子の数を求めよ。書き出しながら、元の方程式と関連づけ、各要素の現れ方に注目するとよいでしょう。例えば、右側に酸素原子が3つありますが、この合計は足し算の結果です。左側:炭素(C3)3個、水素(H8)8個、酸素(O2)2個。右側:炭素(C)1個、水素(H2)2個、酸素(O+O2)3個。
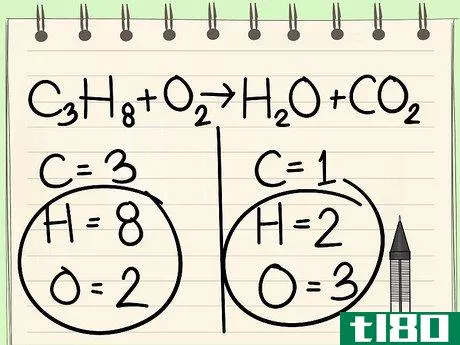
- 3 水素と酸素は両面に出てくることが多いので、最後に取っておく。水素と酸素はどちらも分子によく含まれるので、方程式の両側には水素と酸素があることが多いでしょう。最後にバランスをとるのがベストです。式中の他の原子のバランスをとるために係数が必要になる場合があるので、水素と酸素のバランスをとる前に原子の再計算をする必要があります。
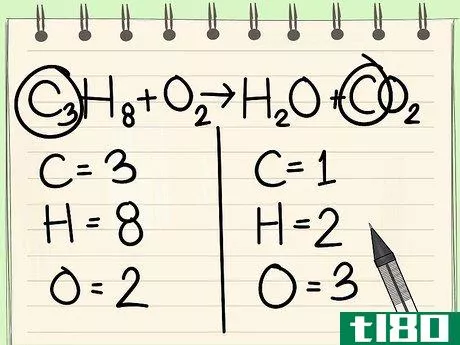
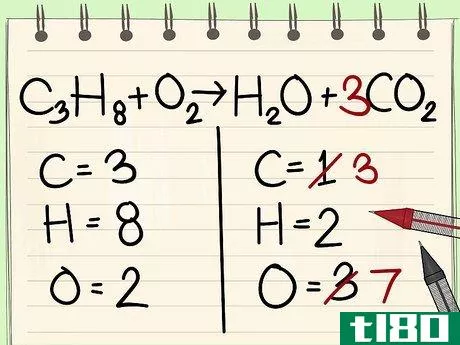
- 4 単一の要素から始める。バランスをとるべき他の元素が複数ある場合は、反応物1分子と生成物1分子にしか現れないものを選ぶ。つまり、まず炭素原子のバランスをとる必要があります。
- 5 因子を用いて炭素原子1個のバランスをとる。式の右辺の炭素原子1個に係数をつけて、左辺の炭素原子3個と釣り合わせる。 C3H8 + O2 --> H2O + 3CO2 右辺の炭素の前の係数3は、左辺の添字3が炭素原子3個であるのと同様に、炭素原子3個であることを表している。化学式では、係数を変えることはできても、添え字を変えることはできない。
- 6 次に、水素原子のバランスをとる。水素と酸素以外の原子のバランスがとれているので、水素原子を解けばいいのです。左側が8個ですね。だから、右側に8個必要なんです。c3H8 + O2 --> 4H2O + 3CO2O 右辺に係数として4を加えました。添え字はすでに水素原子が2個あることを示しており、係数4に添え字2をかけると8個になるからです。
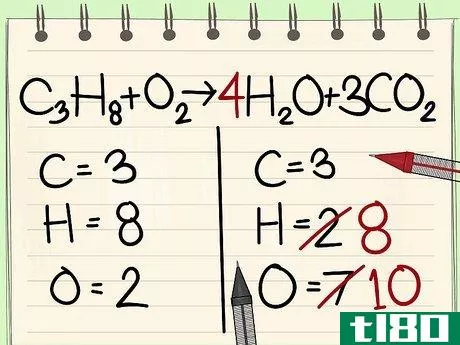
- 7 酸素原子のバランスをとる。他の原子とのバランスに使う係数を考慮することを忘れないでください。式の右辺の分子に係数を加えたため、酸素原子の数が変化していますね。このとき、水の分子には4個の酸素原子があり、二酸化炭素の分子には6個の酸素原子があることになります。これで酸素原子は合計10個になる。式の左辺の酸素分子に5を足すと、両辺に10個の酸素原子があることになります。c3H8 + 5O2 --> 4H2O + 3CO2。方程式が完成しました。
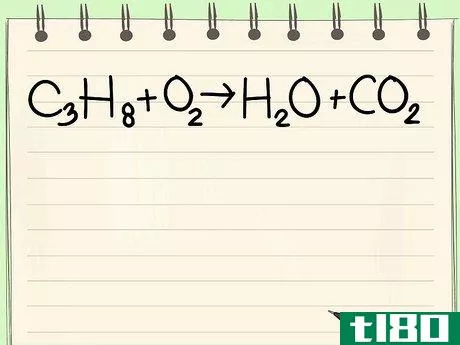


方法2 方法2:完全な代数的平衡状態
ボトムレイ法とも呼ばれるこの方法は、時間はかかるが、より複雑な反応に特に有効である。
- 1 与えられた方程式を書き下す。この例では、PCl5 + H2O --> H3PO4 + HClを使用します。
- aPCl5 + bH2O ---> cH3PO4 + dHCl
- aPCl5 + bH2O --> cH3PO4 + dHCl 左側には2b個の水素原子(H2O1分子につき2個)、右側には3c + d個の水素原子(H3PO41分子につき3個、HCl1分子につき1個)が存在しています。両側の水素原子の数は等しくなければならないので、2bは3c+dに等しくなければならない。これを各元素について行う。
- 4.この連立方程式を解き、すべての係数の値を求めます。方程式より変数の方が多いので、解は複数存在します。各変数が最小の分数でない形になっているものを探す必要があります。これを素早く行うには、変数を取って値を代入すればよい。P:a=cなのでc=1、Cl:5a=dなのでd=5、H:2b=3c+dなのでb:2b=3(1)+52b=3+52b=8b=4となり、a=1b=4c=1d=5と計算される。

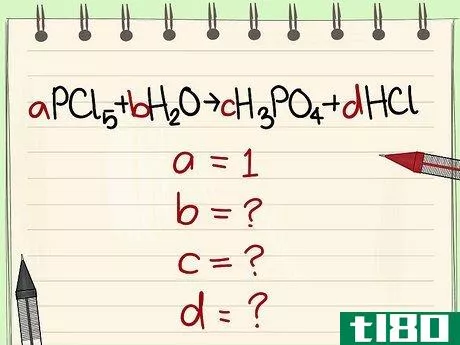


- 行き詰まったら、オンラインバランサーに数式を入力してバランスを取ることもできます。ただ、試験を受けるときはオンラインバランサーにアクセスできないので、当てにならないことを覚えておいてください。
- 単純化することを忘れないでください!すべての係数を同じ数で割ることができる場合、最も単純な結果を得るためにそうしてください。
- 2022-03-04 22:49 に公開
- 閲覧 ( 11 )
- 分類:教育