原子質量の計算方法
原子質量は、原子や分子に含まれるすべての陽子、中性子、電子の総和である。しかし、電子の質量は非常に小さいため、無視できると判断され、計算には含まれない。技術的には正しくないが、この用語は、ある元素のすべての同位体の平均原子質量を指す場合にもよく使われる。この2つ目の定義は、実は元素の相対原子量であり、原子量とも呼ばれる。原子量は、同じ元素の自然界に存在する同位体の平均質量を考慮したものである。例えば、原子質量の値が正しくない場合、...の実験収量に誤差が生じる可能性があるため、化学者はこの2種類の原子質量を区別して作業を行う必要があります。
方法1 方法1/3:周期表で原子量の読み方を探す
- 1 原子の質量がどのように表されるかを理解する。原子質量、すなわち特定の原子や分子の質量は、標準的なSI質量単位であるグラム、キログラムなどで表すことができる。しかし、これらの言葉で表される原子質量はとてつもなく小さいので、原子質量は通常、統一原子質量単位(しばしば「u」または「amu」と略される)またはダルトン(Da)で表現される。原子質量単位の標準は、標準炭素12同位体の質量の1/12に等しい。原子質量は、その元素の原子1モルに含まれるその元素のグラム数である。これは、同じ種類の原子や分子が一定数存在する場合に、質量とモル数の換算が容易にできるため、実用的な計算をする場合には非常に便利な性質である。
- 2 周期表から原子質量を求めよ。ほとんどの標準的な周期表には、各元素の相対原子量(原子重さ)が記載されている。これは、ほとんどの場合、表中のその元素のマスの下に、1文字または2文字の化学記号の下に、数字で書かれている。この数値は通常、整数ではなく10進数で表される。なお、周期表に記載されている相対原子質量は、該当する元素の平均値である。元素には同位体というものがあり、原子核に中性子が1個以上加わるか減らないかで、質量が異なる化学形態になります。したがって、周期表に記載されている相対原子質量は、ある元素の原子の平均値として適しているが、その元素の個々の原子の質量として適しているわけではない。周期表に記載されている相対原子質量は、原子や分子のモル質量を計算するために使用されます。周期表のように原子量をamuで表す場合は、技術的には無単位である。しかし、元素のモル質量(元素原子1モルの質量をグラムで表したもの)は、単純に原子質量に1g/molを乗じることで実用的な量が得られる。例えば、鉄の原子質量は55.847amであり、鉄原子1モルの重さは55.847gであることを意味する。
- 3 周期表の数値が元素の平均原子質量であることを理解する。すでに指摘されているように、周期表の各元素に記載されている相対原子質量は、原子の全同位体の平均値である。この平均値は、多くの実用的な計算-例えば、複数の原子からなる分子のモル質量の計算-に有用である。しかし、個々の原子を扱う場合、この数では不十分な場合があります。数種類の同位体の平均値であるため、周期表の値は個々の原子の原子質量を表す正確な値ではない。個々の原子の質量は、個々の原子に含まれる陽子と中性子の正確な数を考慮して計算する必要があります。



方法2/3:単一原子の原子質量の算出
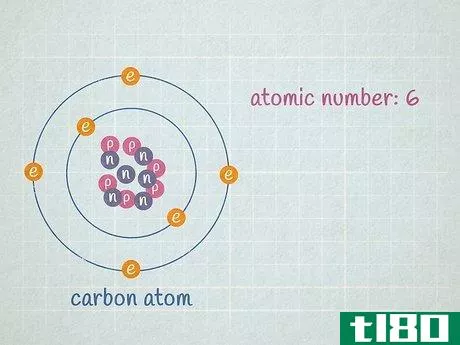
- 1 元素または同位体の原子番号を求めます。原子番号とは、元素に含まれる陽子の数のことで、決して変わることはありません。例えば、すべての水素原子、そして水素原子だけが1個のプロトンを持っています。ナトリウムは原子核に11個の陽子があるので原子番号は11、酸素は原子核に8個の陽子があるので原子番号は8です。原子番号は、元素の1文字または2文字の化学記号の上に記載されている数字で、周期表に記載されています。この数値は常に正の整数である。例えば、炭素原子に注目するとしよう。なお、元素の原子番号は、周期表に記載されている相対的な原子量とは直接的には何ら関係がない。特に周期表の上位の元素では、原子の質量は原子番号の2倍に見えるが、原子の質量は原子番号の2倍で計算されるわけではない。
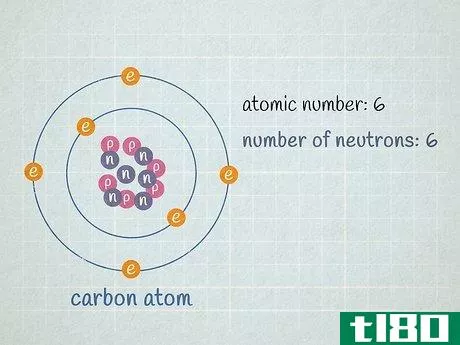
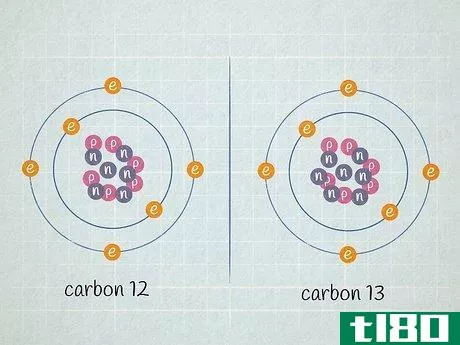
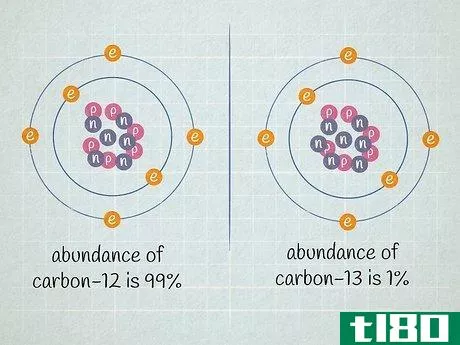
- 2 原子の原子核に含まれる中性子の数を求めよ。ある元素の原子に含まれる中性子の数は変化することがあります。陽子数が同じで中性子数が異なる2つの原子は、どちらも同じ元素であるが、その元素の異なる同位体である。決して変化しない元素の陽子の数とは異なり、ある元素の原子に含まれる中性子の数は頻繁に変化するため、その元素の平均原子質量は2つの整数の間の小数で表現されなければならないのだ。中性子数は、元素の同位体名から判断することができる。例えば、炭素14は炭素12の自然発生的な放射性同位体である。中性子の数は、同位体番号から陽子の数を引くと、14 - 6 = 8個の中性子を持つことになります。私たちが扱っている炭素原子が6個の中性子(12C)を持っているとしよう。炭素の同位体としては圧倒的に多く、全炭素原子の99%近くを占めている。しかし、約1%の炭素原子は7個の中性子を持つ(13C)。その他の種類の炭素原子は、中性子が6個または7個より多かったり少なかったり、非常に少ない数で存在する。
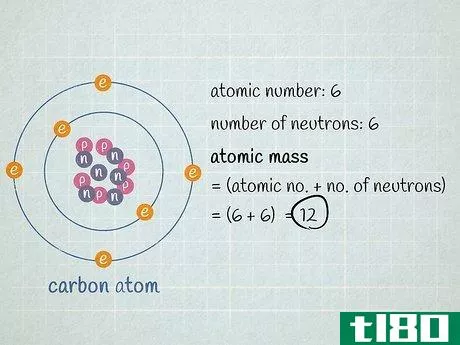
- 3に、陽子と中性子の数を加えたもの。これがその原子の質量である。原子核の周りを回っている電子の数は気にしないでください。電子の質量の合計は非常に小さいので、ほとんどの場合、答えに大きな影響を与えません。この炭素原子の原子質量は、陽子6個+中性子6個=12である。 一方、同位体である炭素13であれば、陽子6個+中性子7個=13であることが分かる。炭素13の実際の原子量は13.003355であり、実験的に決定されたため、より正確である。原子質量は、元素の同位体の数に非常に近い。基本的な計算では、同位体番号は原子質量と等しくなる。実験的に決定する場合、電子の質量寄与が非常に小さいため、原子質量は同位体番号よりもわずかに大きくなる。
方法3 方法3:元素の相対原子質量(原子量)を算出する。
- 1 試料中にどの同位体が含まれているかを判定すること。化学者は通常、質量分析計と呼ばれる特殊な装置を用いて、特定の試料に含まれる同位体の相対的な割合を測定する。しかし、学生レベルの化学では、この情報は科学文献の中の確立された値という形で与えられることが多いのです。ここでは、炭素12と炭素13の同位体を扱うとします。
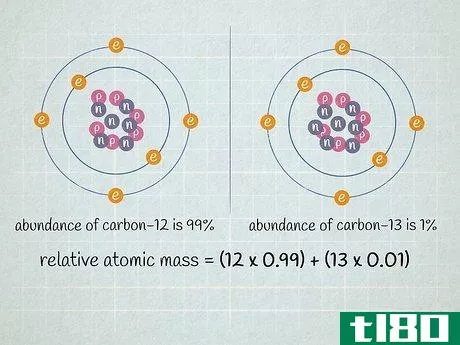
- 2 試料中の各同位体の相対的な存在量を決定すること。ある元素の中で、異なる同位体が異なる割合で存在する。これらの比率は、ほとんどの場合パーセンテージで表示されます。ある同位体は非常にありふれたものであり、ある同位体は非常に稀で、時にはほとんど検出されないほど稀なものである。この情報は、質量分析や参考図書で判断することができます。例えば、炭素12の存在比が99%、炭素13の存在比が1%だとします。他の炭素同位体も存在するが、非常に稀であるため、この設問の例では無視してもよい。
- 3 各同位体の原子質量に、試料中の割合を掛ける。各同位体の原子質量に存在比(10進数で表記)を乗算する。炭素12と炭素13が含まれている試料では、炭素12が99%、炭素13が1%とすると、12(炭素12の原子量)は0.99倍、13(炭素13の原子量)は0.01倍となります。参考書では、ある元素の同位体の既知の全量を基にした比率が記載されている。ほとんどの化学の教科書には、この情報が巻末の表に記載されている。また、質量分析計は測定するサンプルの比率を知ることができます。
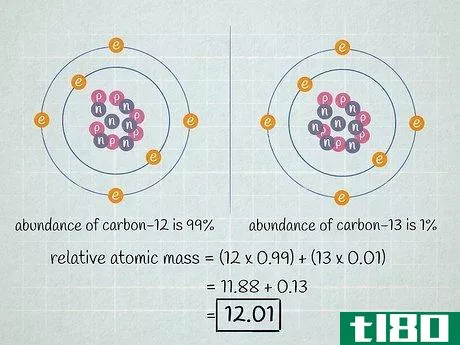
- 4.結果を足し合わせます。前のステップで行った掛け算の積を足し算します。その結果、元素の同位体の原子量の平均値である相対原子質量が算出されます。この値は、特定の元素の同位体ではなく、一般的な元素を論じるときに使われる。この例の相対原子質量は、11.88 + 0.13 = 12.01です。
- 2022-03-11 13:12 に公開
- 閲覧 ( 13 )
- 分類:教育