蒸気圧の計算方法
炎天下に数時間放置した水の入ったペットボトルを開けると、わずかに「ヒュー」という音がしたことはないだろうか。これは、蒸気圧という原理が原因です。化学では、容器内の物質が蒸発する(気体になる)ときに密閉容器の壁にかかる圧力のことを蒸気圧という。ある温度での蒸気圧を求めるには、クラウジウス・クラペイロンの式を用います: ln(p1/p2) = (δhvap/r)((1/t2) - (1/t1)).また、ラウールの法則を使って蒸気圧を求めることができます。psolution = psolventxso...
方法1 方法1/3 クラウジウス・クラペイロン方程式を用いる方法
- 1 クラウジウス・クラペイロン方程式を書きなさい。蒸気圧の時間変化を計算する方程式は、クラウジウス・クラペイロンの方程式として知られている(物理学者ルドルフ・クラウジウスとブノワ・ポール・エミール・クラペイロンの名前にちなんでいる)。物理や化学の授業でよく出題される蒸気圧の問題を解くのに使う公式です。ln(P1/P2) = (ΔHvap/R)((1/T2) - (1/T1)) のような式になります。この式で、変数が指すのは:ΔHvap.液体の気化エンタルピーです。r: 実際の気体定数、または8.314 J/(K × Mol) t2: 蒸気圧を求める温度(または最終温度)。
- 2 知っている変数を記入する。クラウジウス・クラペイロンの方程式は、変数が多いので難しく感じるかもしれませんが、正しい情報があれば、実はそれほど難しくはありません。最も基本的な蒸気圧の問題では、2つの温度の値と1つの圧力の値、あるいは2つの圧力の値と1つの温度の値が得られるが、これさえあれば、問題を解くのは簡単である。質問:393Kでの蒸気圧は何度ですか?温度は2つ、圧力は1つなので、Clausius-Clapeyronの式を使ってもう1つの圧力値を求めることができるのです。変数に代入すると、ln(1/P2) = (ΔHvap/R)((1/393) - (1/295)) となる。クラウジウス・クラペイロンの式では、常にケルビン温度の値を使用しなければならないことに注意してください。P1、P2ともに同じ圧力であれば、どのような圧力値でもかまいません。
- 3 定数を挿入します。クラウジウス・クラペイロンの式には2つの定数、rとΔHvapが含まれています。rは常に8.314J/(K×Mol)に等しくなります。ただし、ΔHvap(蒸発のエンタルピー)は、研究対象の物質の蒸気圧に依存します。前述のように、多くの物質のΔHvapの値は、化学や物理の教科書の後ろのほうや、オンラインでたいてい見つけることができる。この例では、液体を純粋な水と仮定します。ΔHvapの値の表を見ると、ΔHvapは約40.65kJ/molであることがわかる。Hの値にはキロジュールではなくジュールを使っているので、これを40,650ジュール/molと換算することができる。定数を式に代入すると、ln(1/P2) = (40,650/8.314)((1/393) - (1/295)) となります。
- 4.方程式を解きましょう。解こうとしている変数以外の変数を方程式に代入したら、通常の代数学のルールに従って方程式を解いていく。この式(ln(1/P2) = (40,650/8.314)((1/393) - (1/295)) を解く上で唯一難しいのは、自然対数(ln)の扱いだ)。自然対数をキャンセルするには、式の両辺を数学定数eの指数として扱えばよい。つまり、 ln(x) = 2 → eln(x) = e2 → x = e2。0.00084)(1/P2) = e(-4.107)1/P2 = 0.0165P2 = 0.0165-1 = 60.76 atm. これは理にかなっている。密閉容器では、温度をほぼ100度(水の沸点よりほぼ20度)上げると大量の蒸気が発生し、圧力を大幅に上昇させることができるのだ
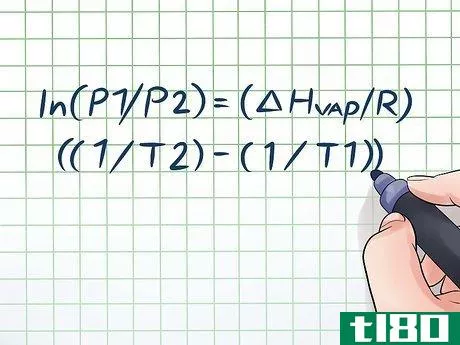


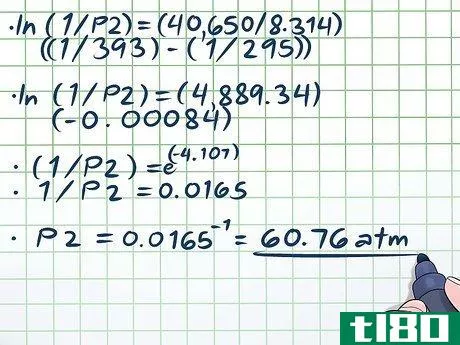
方法2/3:溶解した溶液で蒸気圧を求める
- 1 ラウルの法則を書き出す。実際の生活では、単一の純粋な液体を扱うことはほとんどなく、通常は組成の異なる複数の物質の混合液が扱われる。このような混合物の中で最も一般的なものは、溶質と呼ばれる少量の化学物質を、溶媒と呼ばれる多量の化学物質に溶解して形成される溶液である。Psolution=PsolventXsolvent この式で変数が指すのは、Psolution:溶液全体の蒸気圧(全成分の合計)、PsolventXsolvent:溶液の蒸気圧(全成分の合計)、Psolution:溶液の蒸気圧(全成分の合計)、Psolvent:溶液の蒸気圧(全成分の合計)です。溶媒溶媒の蒸気圧 Xsolvent 「モル分率」などの用語が分からなくても心配はいりません、次のステップで説明します。
- 2 溶液中の溶媒と溶質を特定する。混合液体の蒸気圧を計算する前に、扱っている物質を特定する必要があります。溶質が溶媒に溶けることで溶液ができ、溶ける化学物質は常に溶質で、溶ける化学物質は常に溶媒である。ここで説明する概念を、簡単な例で説明しよう。例えば、単糖類のシロップの蒸気圧を求めるとします。伝統的に、シンプルシロップは1部の砂糖に1部の水を溶かしたものなので、砂糖が溶質で水が溶媒と言います。なお、ショ糖(テーブルシュガー)の化学式はC12H22O11である。 これはすぐに重要になる。
- 3 溶液の温度を求めなさい。前述のクラウジウス・クラペイロンの項で見たように、液体の温度はその蒸気圧に影響を与える。一般に、温度が高いほど蒸気圧は高くなります。温度が高くなると、液体の多くが蒸発して蒸気を形成し、容器内の圧力が高くなります。
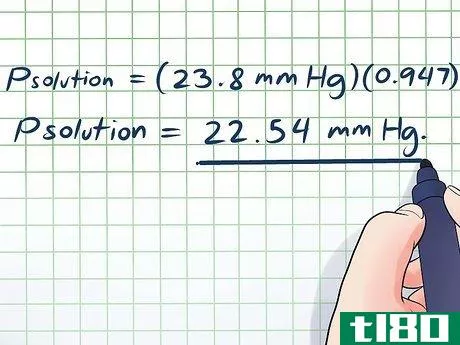
- 4 溶媒の蒸気圧を求めよ。化学文献には、多くの一般的な物質や化合物の蒸気圧の値が記載されていることが多いが、これらの圧力値は通常、物質が25℃/298Kまたは沸点にあるときにのみ適用されるものである。溶液がこれらの温度のいずれかにある場合は、参考値を使用できますが、そうでない場合は、現在の温度での蒸気圧を求める必要があります。クラウジウス・クラペイロンは、基準となる蒸気圧と298K(25℃)をそれぞれP1、T1として使用します。この例では、混合物は25℃にあるので、簡単な基準表を使用できます。25℃における水の蒸気圧は23.8mmHGであることがわかる。
- 5 溶媒のモル分率を求めよ。問題を解く前に最後にやるべきことは、溶媒のモル分率を求めることだ。モル分率を求めるのは簡単で、成分をモル数に換算し、その物質の全モル数に対する各成分の割合を求めればよい。つまり、各成分のモル分率は、(成分のモル数)/(物質の総モル数)に等しい。例えば、シンプルシロップのレシピで、1リットルの水と1リットルのスクロース(砂糖)を使うとしましょう。そのために、各物質の質量を求め、その物質のモル質量を用いてモル数に換算することになります。約1,056.7gモル(水): 1,000g×1mol/18.015g=55.51 moles(スクロース): 1,056.7g×1mol/342.2965g=3.08 moles (なおスクロースは化学式C12H22O11から、モル質量が求められます)。総モル数: 55.51 + 3.08 = 58.59 モル数 水のモル分率: 55.51/58.59 = 0.947
- 6のソリューションを提供します。これでようやくラウールの法則の方程式を解くのに必要なものが揃った。この部分は驚くほど簡単で、冒頭の簡略化したラウールの法則の式(Psolution = PsolventXsolvent)の変数に値を差し込むだけでいいのです。モル比で言えば、大量の水に少量の砂糖が溶けているだけなので(現実世界では両成分は同じ体積だが)、蒸気圧はわずかにしか下がらない。
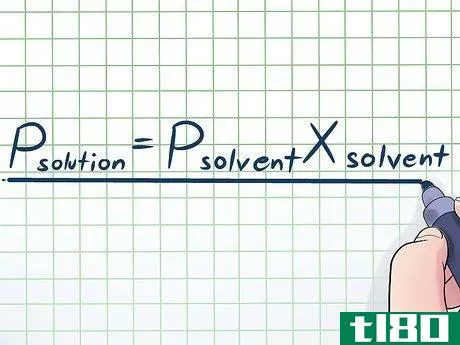



方法3 特殊なケースでの蒸気圧の求め方
- 1 標準的な温度と圧力の条件を意識してください。科学者はしばしば、便利な「デフォルト」として、一連の温度と圧力の値を使用します。これらの値は、標準温度と標準圧力(Standard Temperature and Pressure、略してSTP)と呼ばれています。蒸気圧の問題はSTP条件を参照することが多いので、この値を覚えておくと便利です。STP値は次のように定義されています。温度:273.15 K / 0 C / 32 F圧力:760 mm Hg / 1 atm / 101.325 kilopascals
- 2 クラウジウス・クラペイロン方程式の並べ替えで他の変数を求めることができる第1節の例で、クラウジウス・クラペイロンの式が純物質の蒸気圧を求めるのに非常に有効であることを見た。しかし、すべての問題でP1やP2を求める必要はなく、多くの問題で温度の値や、時にはΔHvapの値を求める必要があります。幸いなことに、このような場合、正しい答えを得るには、方程式を並べ替えて、解こうとしている変数が等号の別の側に来るようにすればよい。例えば、273Kで25torr、325Kで150torrの蒸気圧を持つ未知の液体があるとする。この液体の蒸発エンタルピー(ΔHvap)を求めたい。ln(P1/P2) = (ΔHvap/R)((1/T2) - (1/T1))(ln(P1/P2))/((1/T2) - (1/T1)) = (ΔHvap/R)R × (ln(P1/P2))/((1/T2) - (1/T1) = ΔHvap ここで、(P)の値をプラグに入れると、以下のようになります。8.314 J/(K × Mol) × (-1.79)/(-0.00059) = ΔHvap8.314 J/(K × Mol) × 3,033.90 = ΔHvap = 25,223.83 J/mol
- 3 溶質が蒸気を発生するときの蒸気圧を計算する。上記のラウールの法則の例では、溶質である砂糖は通常の温度ではそれ自体では蒸気を発生しません(考えてみてください、カウンターの上で砂糖の入ったボウルが蒸発するのを見たのはいつが最後でしょうか)。しかし、溶質が蒸発すると、蒸気圧に影響を及ぼします。Psolution = Σ(PcomponentXcomponent) シグマ(Σ)表記は、異なる成分すべての蒸気圧を足すだけで答えが得られることを意味します。ベンゼン60mLとトルエン60mLの合計120mLである。25℃におけるこれらの化学物質の蒸気圧は、ベンゼン95.1mmHg、トルエン28.4mmHgである。これらの値を考慮して、溶液の蒸気圧を求めなさい。質量(ベンゼン):60 ml = 0.060 リットル & 876.50 kg/1,000 リットル = 0.053 kg = 53 g 質量(トルエン):0.060 リットル & 866.90 kg/1,000 リットル = 0. 052 kg = 52g mol (ベンゼン): 53 g x 1 mol/78.11 g = 0.679 mol (トルエン): 52 g x 1 mol/92.14 g = 0.564 mol Total mol: 0.679 + 0.564 = 1.24 mol fraction (benzene): 0.679/1.243 = 0.546 mol fraction (tluene): 0.564/1.243 = 0.454ディゾルブする。溶液 = PbenzeneXbenzene + PtolueneXtoluene 溶液 = (95.1 mmHg)(0.546) + (28.4 mmHg)(0.454) 溶液 = 51.92 mmHg + 12.89 mmHg = 64.81 mmHg



- 上記のクラウジウス・クラペイロンの式を使うには、温度をケルビン(Kで表す)で測定する必要がある。摂氏温度がある場合は、以下の式で換算する必要があります。 tk = 273 + Tc
- エネルギーは供給される熱量に比例し、液体の温度だけが蒸気圧に依存する環境要因であるため、上記の方法は有効である。
- 2022-03-11 15:47 に公開
- 閲覧 ( 8 )
- 分類:教育