phの計算方法
化学溶液のph、つまり酸性か塩基性かを計算するには、phの公式を使います: ph = -log10[h3o+].7より小さいと酸性、大きいと塩基性です。以下の手順で、あらゆる化学溶液のphを計算するためのphの公式の使い方をご覧ください...
方法1 方法1/3:phを理解する
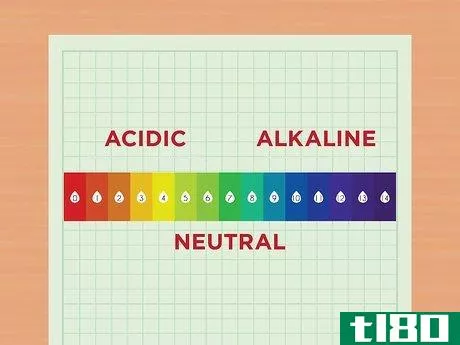
- 1 pHの実態を知る pHとは、溶液中の水素イオンの濃度を示す指標である。水素イオンの濃度が高い溶液は酸性である。水素イオンの濃度が低い溶液は塩基性、またはアルカリ性とも呼ばれます。水素イオンはヒドロニウムイオンとも呼ばれ、H+またはH3O+と略記される。pHスケールについて学びましょう。 pHスケールは通常0から14まで表示されます。数値が小さいほど酸性の溶液であることを示します。数字が大きいほど、より基本的な解決策となります。例えば、オレンジジュースはかなり酸性なので、pHは2です。一方、漂白剤はかなりのアルカリ性であるため、pHは12である。真ん中の数字が中性で、たとえば水はpH7。 pHのレベルは10倍も違うのです。例えば、pH7とpH6を比較した場合、pH6はpH7の10倍の酸性である。また、pH 6はpH 8の100倍の酸性です。
- 2 pH を式で定義する。 pH は負の対数を用いて算出する。pHの式は、pH = -log10[H3O+]のように表されます。この式は、pH = -log10[H+]と見なすこともできる。H3O+でもH+でも式は同じであることを知っておくことが大切です。pHを計算するためには、「負の対数とは何か」をしっかり理解することは必須ではありません。高校や中学校で使う電卓には、対数ボタンがついていることがほとんどです。
- 3 集中力を理解する。濃度とは、同じ溶液の体積に対する、溶液中の化合物の粒子数のことです。pHについては、モル濃度を用いて計算する必要があります。モル濃度とは、モラリティとも呼ばれ、溶液中に溶けている化合物の1リットルあたりのモル数を示す。単位は1リットルあたりのモル数(mol/L)で、モル(M)とも呼ばれる。実験室で溶液を使う場合、濃度はボトルに書かれています。化学の宿題をする場合、通常は濃度が与えられます。
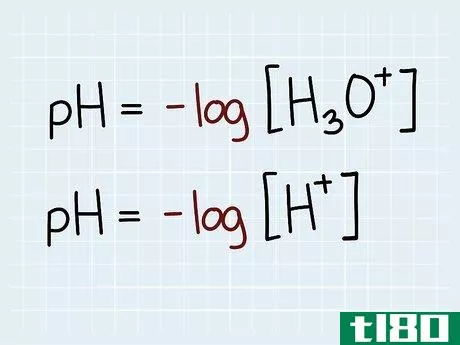

方法2 3つのうち方法2:濃度によるphの算出
- 1 pHの式を覚えましょう。 pHの式は次の通りです:pH = -log10[H3O+].式の中のすべての項が何を表しているのかを確認すること。化学では、通常、角括弧は「濃度」を示す。したがって、pHの式は「pHは水素イオンの濃度の負の対数に等しい」と解釈されることになる。
- 2 実際の濃度を決定する。化学の問題を読んでみましょう。酸または塩基の濃度を決定する。式全体を紙に書き、既知の値のラベルを貼る。例えば、濃度が1.05×10-5Mの場合、pHの式は次のようになります:pH = -log10(1.05 x 10-5 M)
- 3 方程式を解きなさい。pHの式を解くときは、科学計算機を使う必要があります。まず、「マイナス」ボタンを押します。通常は「+/-」と表記します。今度は「ログ」ボタンを入力します。画面には"-log "と表示されているはずです。次に、開いている括弧の一つをクリックし、濃度を入力します。必要であれば、指数を加えることも忘れずに。次にクローズドブラケットを使用します。この時点で、「-log(1.05x10^-5)」と表示されるはずです。解決策をクリックします。pHは約4.98になるはずです。

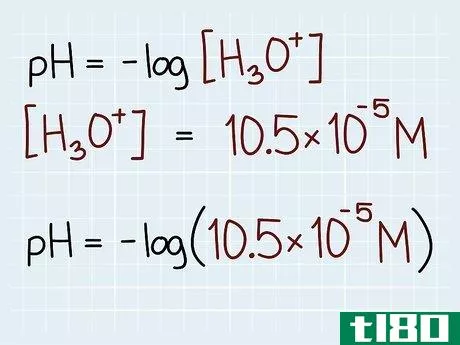

方法3 方法3:pH値による濃度の算出
- 1 既知の未知数を決定する。まずはpHの式を書くことから始めましょう。次に、この値を決めるための式の直下に、自分の持っている値を書き込む。例えば、pH値が10.1であることが分かっている場合、pH式の下の紙にそれを書きます。
- 2 方程式を並べ替える。方程式の並べ替えは、代数学の深い理解が必要です。pHをもとに濃度を計算するには、log10の逆数が「10のべき乗」であることを理解する必要があります。まず、マイナス記号を対数側からpH側に移動させます。それから、(各辺の)10の累乗を上げる。"例えば、pH = -log10[H3O+] は、[H3O+] = 10-pH となる。
- 3 方程式を解く。逆対数を扱う場合、電卓の手順が独特である。対数は10の掛け算であることを忘れないようにしましょう。数式を入力するために、10と入力します。 次に、指数「EXP」ボタンをクリックします。マイナス記号を入力し、その後に値を入力します。解答をクリックします。例えば、pH値が10.1であったとする。10」の後に「EXP」と入力してください。ここで「-/+」と入力すると、マイナスの値が表示されます。最後に、pH値「10.1」を入力します。解答をクリックします。7.943ᴇ-11、つまり7.943*10-11が得られるはずです。 これは、濃度が7.943*10-11 Mであることを意味します。
- 4 答えを考えてみましょう。 pH が 7 の中性溶液は、水素イオン濃度が 10-7 M に相当します。pH が 10.1 の溶液は塩基性なので、この値より水素イオンが少ないことになります。答えの7.943*10-11を見ると、この数字は10-7よりずっと小さいので、この答えは理にかなっていることがわかります。
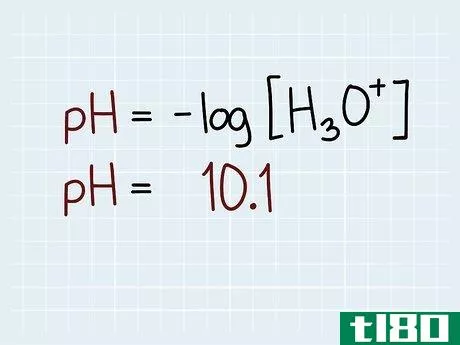



- pHの計算が難しそうな場合は、多くの資料があります。教科書を使い、さらに先生に質問してみましょう。
- 2022-03-11 16:34 に公開
- 閲覧 ( 5 )
- 分類:教育