溶液の濃度の計算方法
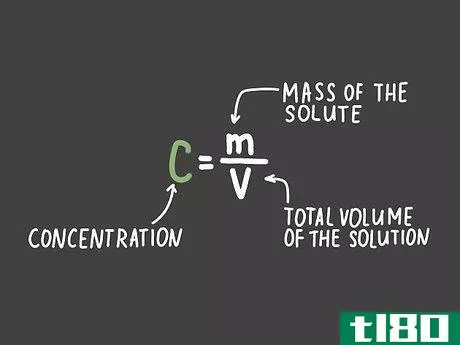
化学では、溶液の濃度は、可溶性物質(溶質と呼ぶ)と他の物質(溶媒と呼ぶ)がどの程度混ざっているかの度合いを意味する。標準式は c = m/v で、c は濃度、m は溶解した溶質の質量、v は溶液の全容積を表す。濃度が小さい場合は、ppm(parts per million)で答えを出すとわかりやすいですよ。実験室では、溶液のモル濃度や、モル濃度を求めるように指示されることがあります...
方法1 方法1/3:体積あたりの質量を表す式を使う
- 1 溶媒と混ざった溶質の質量を求めなさい。溶質とは、混合して溶液を形成する物質のことです。問題で溶質の質量を出した場合は、それを書き出し、正しい単位で表示するようにしましょう。溶質の質量を求める必要がある場合は、実験用のはかりで計量し、その測定値を記録します。使用する溶質が液体であれば、密度の公式で密度D=m/V(mは液体の質量、Vは体積)を求めることも可能です。質量を求めるには、体積に液体の密度をかけます。ヒント:はかりを使う必要がある場合は、溶質を入れる容器の質量を差し引くと、計算がずれてしまいます。
- 2 溶液の全容量を記録する。溶液の総量は、溶媒の量に添加した溶質の量を加えたものです。実験室で体積を調べる場合は、メスシリンダーやビーカーに溶液を入れて混ぜ、測定値を見ます。最も正確な測定値を得るために、溶液の上部にある曲線またはメニスカスから体積を測定してください。溶液の体積を記録する。自分で体積を測っていない場合は、密度の公式を使って溶質の質量を体積に換算する必要があるかもしれません。例えば、2リットルの水に3.45グラムの塩が入っている濃度を求めたい場合、密度の公式を使って塩の体積を求めることができます。教科書やネットで塩の密度を調べ、式中のmを解きます。式は2.16 g/mL = (3.45 g)/V で、各辺を2.16で割って体積を求めます。つまり、V = (3.45 g)/(2.16 g/mL) = 1.60 mL で、溶媒の体積、つまり ma を加えれば、2 L + 1.6 mLとなります。= これをmL単位なしで測るか、リットルに換算して2.002Lとすることができます。
- 3.溶質の質量を溶液の全容積で割る。mは溶質の質量、Vは溶液の全容積とし、C=m/Vの式を書きなさい。質量と体積に求めた値を記入し、それを割って溶液の濃度を求めます。答えに正しい単位を表示することを忘れないでください。この例では、2リットルの水に3.45gの塩がある場合、C = (3.45 g)/(2.002 litres) = 1.723 g/lと計算されます。問題によっては、濃度を特定の単位で表す必要がある場合があるので、最終的な式に入れる前に単位を変換しておくようにしましょう。


方法 2 方法 3 の 2: パーセントまたは 100 万分の 1 の濃度を求める。
- 1 溶質の質量をグラム単位で求めなさい。溶液に混ぜようとする溶質の質量を測ります。溶質を測定するために使用する容器の重量を必ず引いてください。そうしないと、濃度が正確に計算されません。溶質が液体の場合、D = m/Vの式で質量を計算する必要があるかもしれません。ここで、Dは液体の密度、mは質量、Vは体積を表します。教科書やインターネットで液体の密度を調べ、質量の方程式を解きます。
- 2 溶液の全質量をグラム単位で求めよ。溶液の全質量は、溶媒の質量に溶質の質量を加えたものです。実験用のはかりで質量を測定するか、密度の式D = m/Vで溶媒の体積を質量に換算します。溶質の質量と溶媒の質量を足して、最終的な体積を求めます。例えば、10gのココアパウダーを1.2リットルの水に混ぜたときの濃度を知りたい場合、密度の式で水の質量を求めることができます。水の密度は1,000g/Lなので、1,000g/L = m/(1.2 L)となります。各辺に1.2リットルをかけて質量を求めると、m = (1.2 L)(1,000 g/L) = 1,200 gとなり、ココアパウダーの質量を加えて1,210 gとなる。
- 溶質の質量を溶液の全質量で割る。濃度C=溶質の質量/溶液の全質量となるように式を設定します。値を入力し、方程式を解いて溶液の濃度を求めます。この例では、C = (10g) / (1,210g) = 0.00826となります。
- 4 濃度のパーセンテージを求める場合は、答えに100を掛けます。濃度をパーセントで表示するように言われた場合は、今求めた答えに100を掛けます。最終的な答えにはパーセント記号を付けてください。この例では、濃度パーセントは (0.00826)(100) = 0.826% となる。
- 5濃度に1,000,000を乗じると、parts per millionとなる。求めた濃度の数値に1,000,000または106をかけると、この数値が溶質の百万分の一になる。この例では、ppm = (0.00826)(1,000,000) = 8,260 ppm。ヒント:百万分の一は、パーセントよりも書きやすく理解しやすいので、非常に小さな濃度に通常使用されます。
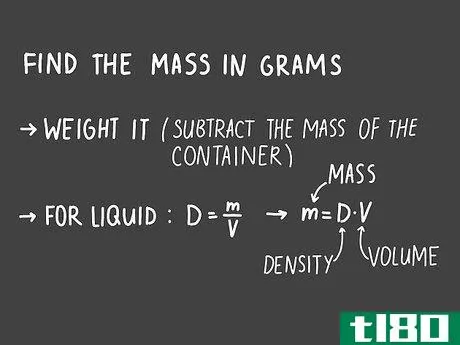




方法3 方法3:モル比の計算
- 1 溶質の原子量を足し合わせて、モル質量を求めます。使用する溶質の化学式に含まれる元素を調べます。原子質量とモル質量は同じなので、溶質中の各元素の原子質量を列挙せよ。溶質中の原子量を足し合わせて総モル質量を求めます。最終的な測定値を g/mol で表示する。例えば、溶質が水酸化カリウム(KOH)の場合、カリウム、酸素、水素の原子量を求め、それらを足し合わせます。この場合、モル質量=39+16+1=56g/molとなる。モル質量は、主に化学の分野で、使用する溶質の化学組成が分かっている場合に使用されます。
- 2 溶質の質量をモル質量で割って、モル数を求めます。必要であれば、実験用のはかりを使って、溶液に加える溶質の質量を求めます。正確な測定値を得るために、容器の質量を必ず差し引いてください。求めた質量をモル質量で割って、使用する溶質のモル数がわかるようにします。答えに「モル」をつけてください。例えば、25gの水酸化カリウム(KOH)のモル数を知りたい場合は、mol = (25g)/(56g/mol) = 0.45 mol 溶質の質量がグラムでない場合は、グラムに変換する。
- 3 溶液の体積をリットルに換算する。溶質を混ぜる前の溶媒の体積を求めます。測定値が与えられていない場合は、フラスコやメスシリンダーを使用して測定値を求めてください。ミリリットル単位なら、1,000で割ってリットルに換算します。この例では、400mlの水を使うのであれば、1000で割ってリットルに換算すると、0.4リットルになります。もし、お使いの溶剤がすでにリットル単位で表示されている場合は、このステップは省略できます。溶質と溶媒を混ぜたときに体積が大きく変化する場合は、代わりに全容積を使用します。
- 溶液の体積(リットル)を溶質のモル数で割る。モル数係数M=mol/V(molは溶質のモル数、Vは溶媒の体積)となるように式を設定する。この例では、M = (0.45 mol)/(0.4 L) = 1.125 Mとなる。




- 実験室で溶質の添加量がわからない場合、他の反応性化学物質で滴定試験を行うことができます。化学量論による化学式のバランスの取り方は学ぶ必要があります。
- 2022-03-11 16:52 に公開
- 閲覧 ( 9 )
- 分類:教育