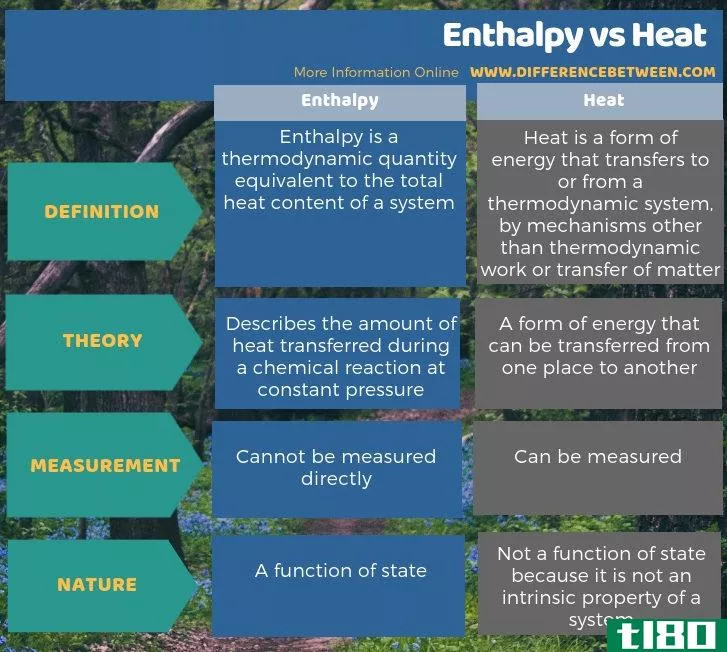
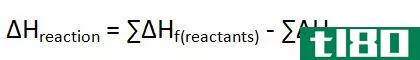焓和热之间的关键区别在于,焓是在恒压下化学反应过程中传递的热量,而热是能量的一种形式。
为了研究化学,我们把宇宙分成两个部分:一个系统和一个周围。系统是我们调查的对象,其余的是周围的。热和焓是描述系统能量流动和性质的两个术语。
目录
1. 概述和关键区别
2. 什么是焓
3. 什么是热
4. 并列比较-焓与热以表格形式
5. 摘要
什么是焓(enthalpy)?
在热力学中,系统的总能量是内部能量。内能指定系统中分子的总动能和势能。系统的内部能量可以通过对系统进行工作或加热来改变。然而,内部能量的变化并不等于当系统能够改变其体积时作为热量传递的能量。
焓是一种热力学性质,可以用H表示。这个项的数学关系如下:
H=U+PV
这里,H是焓,U是内能,P是压力,V是系统的体积。这个方程表明,在恒压下作为热量提供的能量等于焓的变化。术语pV表示系统在恒定压力下改变体积所需的能量。因此,焓基本上是恒压下反应的热量。
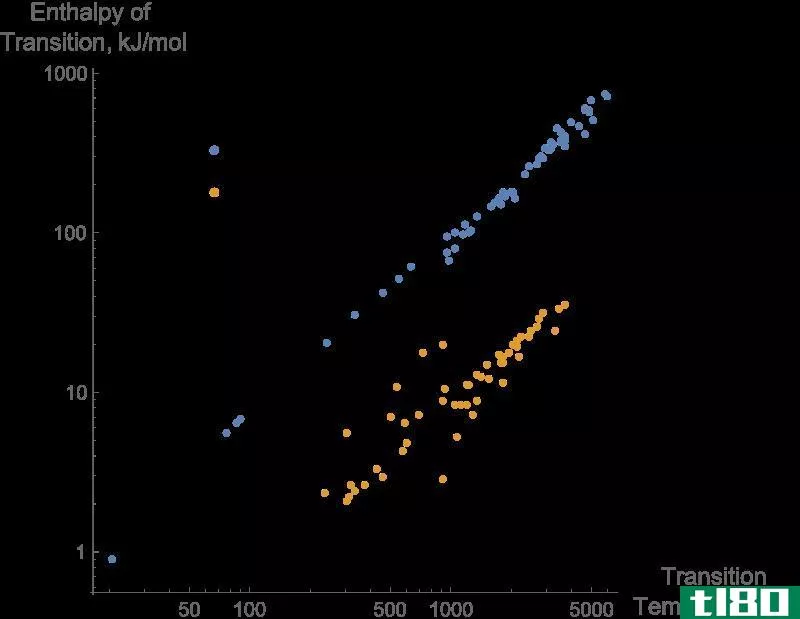
图01:物质相变的焓变化
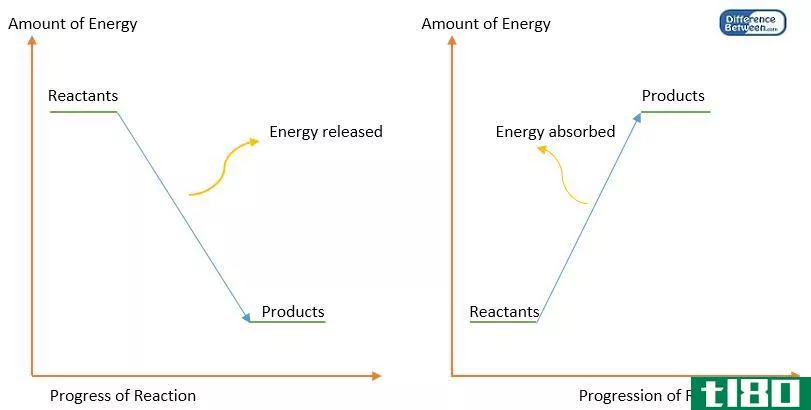
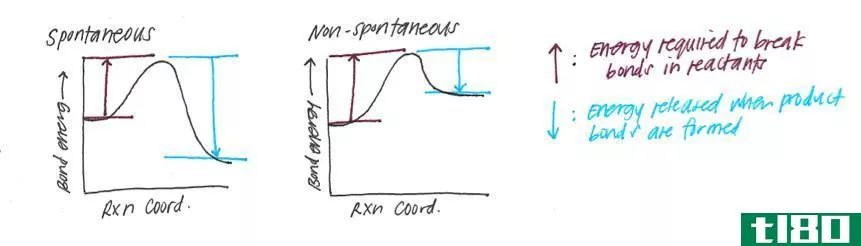
此外,通过从产物的焓值中减去反应物的焓,可以得到在给定温度和压力下反应的焓变化(∆H)。如果该值为负值,则反应是放热的。如果该值为正,则该反应为吸热反应。任何一对反应物和产物之间的焓变化与它们之间的路径无关。此外,焓的变化取决于反应物的相。例如,当氧气和氢气反应生成水蒸气时,焓变为-483.7kj。但是,当相同反应物反应生成液态水时,焓变为-571.5kj。
什么是热(heat)?
一个系统做功的能力就是这个系统的能量。我们可以在系统上做功,也可以由系统做功,从而相应地增加或减少系统的能量。一个系统的能量是可以改变的,不仅通过功本身,也可以通过其他方式。当一个系统的能量因系统与周围环境的温差而变化时,我们把这种能量称为热(q);也就是说,能量以热的形式传递。

热传递是根据温度梯度从高温到低温进行的。此外,这一过程一直持续到系统和周围环境之间的温度达到相同水平。有两种类型的传热过程。它们是吸热过程和放热过程。吸热过程是能量以热的形式从周围环境进入系统的过程,而放热过程是热量从系统以热的形式传递到周围环境的过程。
焓(enthalpy)和热(heat)的区别
大多数情况下,我们可以互换使用焓和热,但是焓和热之间有细微的区别。焓和热之间的关键区别在于,焓描述的是在恒压下化学反应过程中传递的热量,而热量是能量的一种形式。此外,焓是状态的函数,而热不是,因为热不是系统的固有属性。另外,我们不能直接测量焓,所以我们必须通过方程来计算;然而,我们可以直接测量作为温度变化的热。
总结 - 焓(enthalpy) vs. 热(heat)
我们经常交替使用焓和热这两个词,但有一点区别,焓和热是,焓描述的是在恒定压力下化学反应过程中传递的热量,而热是能量的一种形式。
引用
1赫尔曼斯汀,安妮·玛丽。“化学和物理中的焓定义”,ThoughtCo,2019年8月22日,可在这里查阅