吉布斯(gibbs)和亥姆霍兹自由能(helmholtz free energy)的区别
主要区别吉布斯(main difference gibbs) vs. 亥姆霍兹自由能(helmholtz free energy)
化学反应热力学中有四种主要的热力学势。它们是内能,焓,亥姆霍兹自由能和吉布斯自由能。内能是与分子运动有关的能量。焓是系统的总热含量。亥姆霍兹自由能是可以从系统中获得的“有用功”。吉布斯自由能是系统能得到的最大可逆功。所有这些术语都描述了特定系统的行为。吉布斯自由能与亥姆霍兹自由能的主要区别在于吉布斯自由能是在定压下定义的,亥姆霍兹自由能是在定容下定义的。
覆盖的关键领域
1.什么是吉布斯自由能-定义、计算公式和应用2.什么是亥姆霍兹自由能-定义、计算公式和应用3.吉布斯自由能和亥姆霍兹自由能之间的区别-主要区别的比较
Key Terms: Enthalpy, Gibbs Free Energy, Helmholtz Free Energy, Internal Energy, Thermodynamic Potentials 
什么是吉布斯自由能(gibbs free energy)?
吉布斯自由能可以定义为从一个特定体系中得到的最大可逆功。为了计算吉布斯自由能,系统应该处于恒温恒压下。符号G表示吉布斯自由能。吉布斯自由能可以用来预测化学反应是自发的还是非自发的。
吉布斯自由能由SI单位J(焦耳)计算。吉布斯自由能给出了由封闭系统而不是扩展系统所做的最大工作量。当考虑可逆过程时,可以得到符合此定义的实际能量。吉布斯自由能总是计算为能量的变化。这是作为ΔG。这等于初始能量和最终能量之间的差值。吉布斯自由能的方程如下所示。
方程式
g=u–ts+pv
其中,G是吉布斯自由能,
U是系统的内部能量,
T是系统的绝对温度,
V是系统的最终体积,
P是系统的绝对压力,
S是系统的最终熵。
但是,系统的焓等于系统的内能加上压力和体积的乘积。然后,可以如下修改上述等式。
g=h–ts
或
δg=δh–t型δs
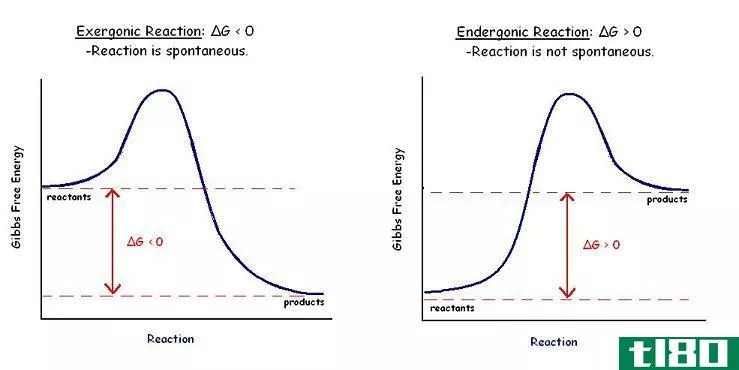
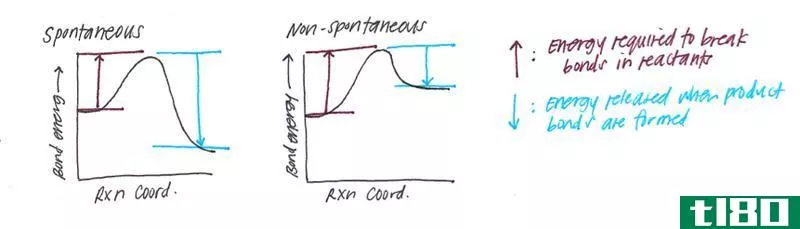
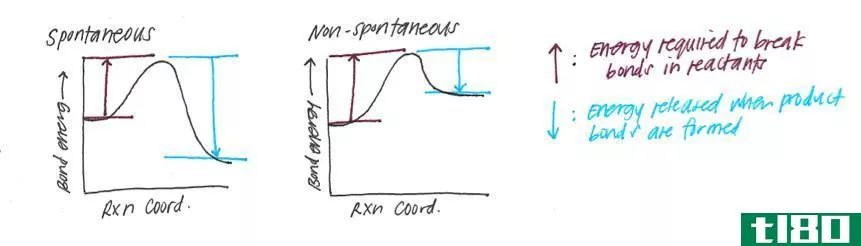
如果ΔG是负值,也就是说,反应是自发的。如果ΔG为正值,则反应为非自发反应。

Figure 1: An Exothermic Reaction
否定的ΔG表示阴性ΔH值。这意味着能量被释放到周围。这叫做放热反应。积极的ΔG表示阳性ΔH值。这是一个吸热反应。
什么是亥姆霍兹自由能(helmholtz free energy)?
亥姆霍兹自由能可以定义为一个封闭系统所能获得的“有用功”。这个术语定义为恒定的温度和恒定的体积。这个概念是由德国科学家赫尔曼·冯·赫尔姆霍兹提出的。这一项可以用下式表示。
方程式
a=u–ts
式中,A是亥姆霍兹自由能,
U是内能,
T是绝对温度,
S是系统的最终熵。
对于自发反应,ΔA为阴性。因此,当考虑系统中的化学反应时,在恒定温度和体积下的能量变化应为负值,以便使其成为自发反应。
吉布斯(gibbs)和亥姆霍兹自由能(helmholtz free energy)的区别
定义
吉布斯自由能:吉布斯自由能可以定义为从一个特定系统中得到的最大可逆功。
亥姆霍兹自由能:亥姆霍兹自由能可以定义为一个封闭系统可以获得的“有用功”。
常数参数
吉布斯自由能:吉布斯自由能是在恒温恒压下计算的。
亥姆霍兹自由能:亥姆霍兹自由能是在恒定的温度和体积下计算出来的。
应用
吉布斯自由能:吉布斯自由能经常被使用,因为它考虑了恒压条件。
亥姆霍兹自由能:亥姆霍兹自由能没有太多的使用,因为它考虑了一个恒定的体积条件。
化学反应
吉布斯自由能:当吉布斯自由能变化为负时,化学反应是自发的。
亥姆霍兹自由能:当亥姆霍兹自由能变化为负时,化学反应是自发的。
结论
吉布斯自由能和亥姆霍兹自由能是热力学上用来描述系统行为的两个热力学项。这两个术语都包括系统的内能。吉布斯自由能与亥姆霍兹自由能的主要区别在于吉布斯自由能是在定压下定义的,而亥姆霍兹自由能是在定容下定义的。
引用
1.“亥姆霍兹自由能。”亥姆霍兹自由能和吉布斯自由能,这里有。查阅日期:2017年9月25日Gibbs free energy。“维基百科,维基媒体基金会,2017年9月12日,可在此处查阅。查阅日期:2017年9月25日赫尔姆霍兹自由能源。“维基百科,维基媒体基金会,2017年9月12日,可在此处查阅。2017年9月25日查阅。 2.“吉布斯自由能源”,维基百科,维基媒体基金会,2017年9月12日, 3.“亥姆霍兹自由能源”,维基百科,维基媒体基金会,2017年9月12日,
- 发表于 2021-06-29 14:49
- 阅读 ( 1190 )
- 分类:科学
你可能感兴趣的文章
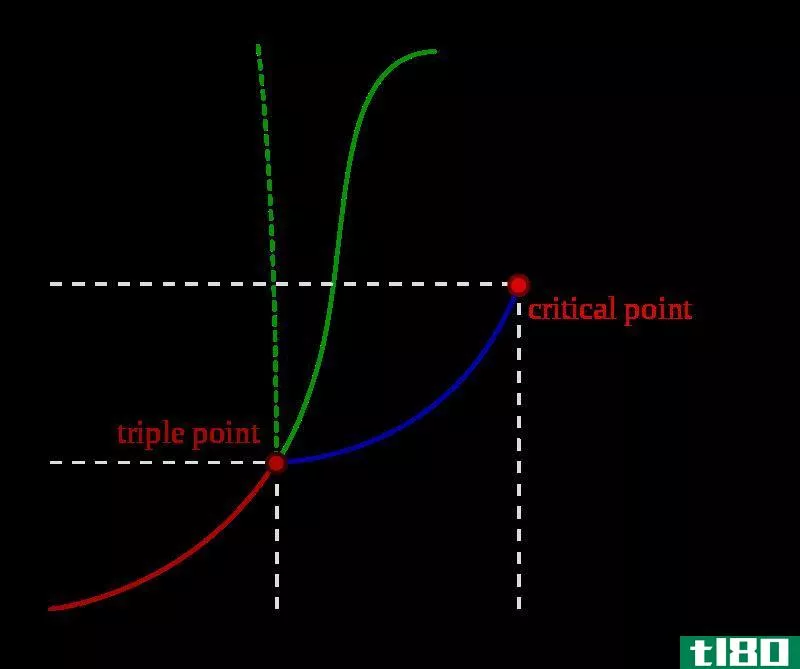
是的(true)和伪临界性质(pseudo critical properties)的区别
...算的。在计算这些值时,它们同时满足二次型和三次型的亥姆霍兹自由能的展开,作为临界点摩尔数的函数。 图01:显示临界点的相图 什么是伪临界性质(pseudo critical properties)? 伪临界性质是指系统中每个纯组分对特定反应的明...
- 发布于 2020-09-15 23:30
- 阅读 ( 489 )
自发的(spontaneous)和非自发性反应(nonspontaneous reactions)的区别
...些反应有利于在反应发生的条件下生成产物。自发反应的吉布斯自由能是负值。 大多数自发反应发生得很快,因为它有利于形成产物,而不是保持反应物原样。例:氢气燃烧。但有些反应非常缓慢。把石墨转化成钻石。此外,...
- 发布于 2020-10-17 23:54
- 阅读 ( 1298 )
吉布斯自由能(gibbs free energy)和标准自由能(standard free energy)的区别
吉布斯自由能和标准自由能的关键区别在于,吉布斯自由能取决于实验条件,而标准自由能描述的是处于标准状态的反应物和产物的吉布斯自由能。 吉布斯自由能和标准自由能是物理化学中常见的术语。这两个术语给出了一...
- 发布于 2020-10-18 00:01
- 阅读 ( 439 )
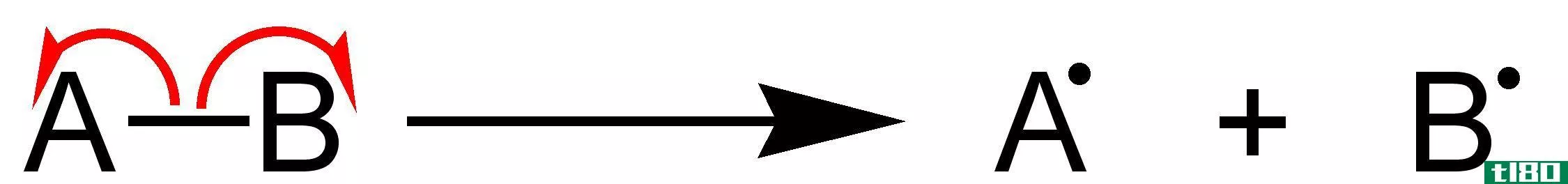
均裂的(homolytic)和异溶键离解能(heterolytic bond dissociation energy)的区别
...键所需的能量。化学键的溶血是键的对称断裂,形成两个自由基,而不是两个离子。在这里,原子间的键电子被分成两半,由两个原子占据。例如,每一个不裂解的自由基都有一个不裂解的自由基。 图1:均分解 键离解能是指在...
- 发布于 2020-10-19 07:36
- 阅读 ( 334 )
自由能(free energy)和焓(enthalpy)的区别
...热力学中经常讨论两种主要的自由能:亥姆霍兹自由能和吉布斯自由能。 亥姆霍兹自由能 亥姆霍兹自由能是在封闭的热力学系统中,在恒定的温度和体积下进行热力学功的能量。因此,Helmholtz能量的负值表示热力学系统通过保...
- 发布于 2020-10-19 11:40
- 阅读 ( 608 )
溶剂化能(solvation energy)和晶格能(lattice energy)的区别
...-溶剂化能与晶格能 溶剂化能是溶质溶解在溶剂中时,其吉布斯能的变化。晶格能要么是离子在晶格形成过程中释放的能量,要么是分解晶格所需的能量。溶剂化能和晶格能的关键区别在于,溶剂化能给出溶质在溶剂中溶解时的...
- 发布于 2020-10-20 03:46
- 阅读 ( 774 )
键能(bond energy)和键离解能(bond dissociation energy)的区别
...423 kJ/mol和339 kJ/mol,这是因为第一个键断裂通过均裂形成自由基物种,因此第二个键断裂发生在自由基物种上,比第一个需要更多的能量。同样,键离解能也会一步一步地改变。 键能(bond energy)和键离解能(bond dissociation energy)的区...
- 发布于 2020-10-21 13:16
- 阅读 ( 766 )
状态函数(state function)和路径函数(path function)的区别
状态函数(state function)和路径函数(path function)的区别 热力学是物理化学的一个重要分支,它揭示了不同形式的能量和功之间的热化学关系。有四个热力学定律用于描述热力学系统的行为。状态函数和路径函数是表示系统不同热...
- 发布于 2020-10-24 02:43
- 阅读 ( 1410 )
看这个:戴森在寻找一个沉默的球迷
...看下面的视频,看看戴森的工程师们是如何重组气流、**亥姆霍兹空腔(专门设计用来降低噪音的腔室)以及对整个基地内部进行彻底检修,**出一个他们声称你只能看到,却永远听不到的风扇的。
- 发布于 2021-04-25 12:21
- 阅读 ( 106 )
键能(bond energy)和键离解能焓(bond dissociation energy enthalpy)的区别
...。 键离解能 键离解能提供了从产生特定键的原子中形成自由基所需的能量。 例子 键能 在化学中,键能(E)或键焓(H)是化学键中键强度的量度…例如,甲烷(CH4)中的(C-H)碳-氢键能是将一个CH4分子分解成一个碳(C)原子...
- 发布于 2021-06-26 10:13
- 阅读 ( 460 )