使用单位和稀释度计算浓度
计算化学溶液的浓度是所有化学学生在学习早期必须掌握的一项基本技能。什么是专注?浓度是指溶解在溶剂中的溶质量。我们通常认为溶质是添加到溶剂中的固体(例如,向水中添加食盐),但溶质很容易存在于另一个相中。例如,如果我们在水中加入少量乙醇,那么乙醇就是溶质,水就是溶剂。如果我们在大量的乙醇中加入少量的水,那么水就是溶质。

如何计算浓度单位
一旦确定了溶液中的溶质和溶剂,就可以确定其浓度。浓度可以用几种不同的方式表示,使用质量百分比、体积百分比、摩尔分数、摩尔浓度、摩尔浓度或正态浓度。
按质量计的成分百分比(%)
这是溶质质量除以溶液质量(溶质质量加溶剂质量)乘以100。示例:测定含20 g盐的100 g盐溶液的质量百分比组成。溶液:20 g NaCl/100 g溶液x 100=20%NaCl溶液
体积百分比(%v/v)
在制备液体溶液时,通常使用体积百分比或体积/体积百分比。体积百分比定义为:v/v%=[(溶质体积)/(溶液体积)]x 100%注意,体积百分比与溶液体积有关,而不是溶剂体积。例如,葡萄酒的酒精含量约为12%。这意味着每100毫升葡萄酒中含有12毫升乙醇。重要的是要认识到液体和气体的体积不一定是添加剂。如果你将12毫升乙醇和100毫升葡萄酒混合,你将得到少于112毫升的溶液。另一个例子是,70%v/v的乙醇可以通过取700毫升异丙醇并加入足够的水来制备,以获得1000毫升的溶液(不是300毫升)。
摩尔分数(x)
这是化合物的摩尔数除以溶液中所有化学物质的总摩尔数。请记住,溶液中所有摩尔分数之和始终等于1。例如:当92 g甘油与90 g水混合时,溶液组分的摩尔分数是多少?(水的分子量=18;甘油的分子量=92)解决方案:90克水=90克x1摩尔/18克=5摩尔水92克甘油=92克x1摩尔/92克=1摩尔甘油醇摩尔=5+1=6摩尔水=5摩尔/6摩尔=0.833x甘油=1摩尔/6摩尔=0.167通过确保摩尔分数加起来等于1:x水+x甘油=0.833+0.167=1.000来检查你的数学是个好主意
摩尔浓度(m)
摩尔浓度可能是最常用的浓度单位。它是每升溶液中溶质的摩尔数(不一定与溶剂的体积相同!)。例如:将水添加到11 g CaCl2中制成100 mL溶液时,溶液的摩尔浓度是多少?(CaCl2的分子量=110)溶液:11 g CaCl2/(110 g CaCl2/mol CaCl2)=0.10 mol CaCl2100 mL x 1 L/1000 mL=0.10 L极性=0.10 mol/0.10 L极性=1.0 M
摩尔浓度(m)
摩尔浓度是每千克溶剂中溶质的摩尔数。由于25°C下的水密度约为1千克/升,因此摩尔浓度约等于该温度下稀释水溶液的摩尔浓度。这是一个有用的近似值,但请记住,它只是一个近似值,不适用于溶液处于不同温度、未稀释或使用水以外的溶剂的情况。例如:10 g NaOH溶液在500 g水中的摩尔浓度是多少?(NaOH的分子量为40)溶液:10 g NaOH/(40 g NaOH/1 mol NaOH)=0.25 mol NaOH 500 g水x 1 kg/1000 g=0.50 kg水摩尔浓度=0.25 mol/0.50 kg摩尔浓度=0.05 M/kg摩尔浓度=0.50 M
正态性(n)
正常浓度等于每升溶液中溶质的克当量。克当量或当量是对给定分子反应能力的测量。正态浓度是唯一依赖于反应的浓度单位。例如:对于酸碱反应,1 M硫酸(H2SO4)为2 N,因为每摩尔硫酸提供2摩尔H+离子。另一方面,由于1摩尔硫酸提供1摩尔硫酸离子,因此1摩尔硫酸对于硫酸盐沉淀而言为1 N。
- 克每升(g/L)这是一种基于克每升溶液中溶质制备溶液的简单方法。
- 形式(F)形式溶液表示为每升溶液的配方重量单位。
- 百万分之几(ppm)和十亿分之几(ppb)用于极稀溶液,这些单位表示每100万份溶液或每10亿份溶液中溶质的比例。例如:发现水样含有2 ppm的铅。这意味着每百万个零件中就有两个是铅。因此,在一克水样本中,百万分之二克是铅。对于水溶液,假设这些浓度单位的水密度为1.00 g/ml。
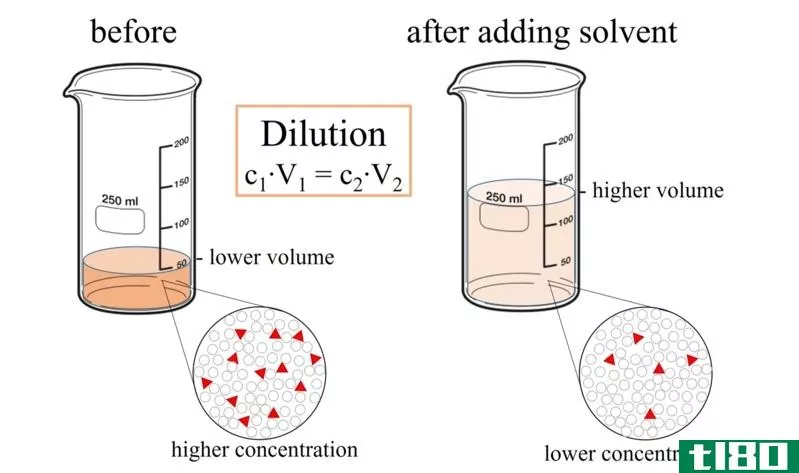
如何计算稀释度
每当你向溶液中加入溶剂时,你都要稀释溶液。添加溶剂可得到浓度较低的溶液。通过应用以下方程式,可以计算稀释后溶液的浓度:
MiVi=MfVf
其中M表示摩尔浓度,V表示体积,下标i和f表示初始值和最终值。
示例:制备300毫升1.2毫升氢氧化钠需要多少毫升5.5毫升氢氧化钠?
溶液:5.5米x V1=1.2米x 0.3升1=1.2米x 0.3升/5.5 MV1=0.065升1=65毫升
因此,为了制备1.2 M NaOH溶液,将65 mL 5.5 M NaOH倒入容器中,并加水,以获得300 mL最终体积
- 发表于 2021-09-17 03:10
- 阅读 ( 277 )
- 分类:数学
你可能感兴趣的文章
稀释(dilution)和滴度(titre)的区别
...终点或达到的浓度阈值。此外,动物脂肪的滴度值用温度单位表示为40摄氏度。这是因为脂肪下面是油脂,上面是油脂。 稀释(dilution)和滴度(titre)的区别 稀释是降低样品浓度的过程,而滴定是通过滴定法测定的样品浓度。稀释度...
- 发布于 2020-10-17 07:34
- 阅读 ( 774 )
稀释(dilution)和稀释系数(dilution factor)的区别
...释的原始溶液的体积。这个关系也可以和溶质的质量一起使用。 稀释系数计算 稀释系数=最终体积(V2)/初始体积(V1) 例:加入200mL水,稀释200mL KMnO4水溶液, 稀释系数=(200mL+200mL)/200mL =400毫升/200毫升 =2个 图02:稀释系数图 ...
- 发布于 2020-10-19 09:06
- 阅读 ( 2326 )
浓度(concentration)和摩尔浓度(molarity)的区别
...浓度,还需要知道溶液中的相对溶解量。浓度是我们广泛使用的术语;然而,摩尔浓度也是一种浓度测量方法。 目录 1. 概述和主要区别 2. 什么是专注 3. 什么是摩尔浓度 4. 并列比较-以表格形式显示浓度与摩尔浓度 5. 摘要 什么...
- 发布于 2020-10-24 17:12
- 阅读 ( 789 )
首席财务官(cfu)和mpn公司(mpn)的区别
...本 你可以下载这篇文章的PDF版本,并根据引文注释离线使用。请在此下载PDF版本CFU和MPN之间的差异。 引用 “群体形成单位”,维基百科。维基媒体基金会,2017年5月28日。网状物。这里有。2017年6月1日。“微生物学-014-最可能数...
- 发布于 2020-10-25 04:10
- 阅读 ( 395 )
稀释(dilution)和浓度(concentration)的区别
...溶剂来降低溶液中溶质浓度的过程。因此,我们可以减少单位体积溶液中存在的溶质量。如果我们提到“稀释”,它的意思是“添加更多的溶剂而不添加溶质”。但是,在加入溶剂后,我们应该彻底混合溶液,以获得均匀的溶液...
- 发布于 2020-11-05 09:09
- 阅读 ( 988 )
稀释(dilution)和稀释系数(dilution factor)的区别
...主题在公司中非常重要,特别是工业公司,他们是供人类使用和消费的材料和产品的生产商。因此,这是他们应用的一个重要概念。 总结: 1.稀释是一个没有公式的过程,而稀释因子需要一个公式才能得到答案。2.稀释是减少浓...
- 发布于 2021-06-23 19:28
- 阅读 ( 468 )
摩尔浓度(molarity)和摩尔浓度(molality)的区别
...于计算已稀释物质的浓度。 当不需要精确精度时,可以使用摩尔浓度。但是,它会受到温度变化的影响,因为它是体积测量,所以在某些情况下可能不适合使用。 在某些情况下,摩尔浓度和摩尔浓度可能是相同的。例如,一公...
- 发布于 2021-06-25 05:46
- 阅读 ( 562 )
摩尔浓度(molarity)和正态性(normality)的区别
...为eq/L,其中“eq”表示“当量”。对于小规模计算,我们使用单位meq/L,其中“meq”表示“毫当量”。 当量浓度用于表示酸碱反应中的氢离子(H3O+)浓度或羟基离子(OH-)浓度。但当不同的反应发生时,同一种化合物可能有不...
- 发布于 2021-06-29 13:32
- 阅读 ( 635 )
mpn公司(mpn)和cfu公司(cfu)的区别
...度的测量值。 他们测量样本中微生物的活菌数。 两者都使用10倍稀释样品进行计数。 mpn公司(mpn)和cfu公司(cfu)的区别 定义 MPN:一种通过在10倍稀释液中复制液体肉汤生长来估计样品中活微生物浓度的方法 菌落总数:测定样品中...
- 发布于 2021-06-30 16:45
- 阅读 ( 219 )
如何制作磷酸盐缓冲液(make a phosphate buffer)
...起见,此示例计算创建1升缓冲区。 步骤2.测定酸碱比 使用Henderson Hasselbalch(HH)方程式(如下)确定所需酸碱比,以制备所需pH值的缓冲液。使用最接近所需pH值的pKa值;该比率指与pKa对应的酸碱共轭对。 HH方程:pH=pKa+log(...
- 发布于 2021-09-02 18:26
- 阅读 ( 264 )