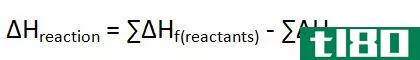如何计算化学反应的焓(calculate the enthalpy of a chemical reaction)
方法1方法1/3:解决焓问题
- 1确定反应产物和反应物。任何化学反应都涉及两类化学物质——产物和反应物。产品是由反应产生的化学物质,而反应物是相互作用、结合或分解生成产品的化学物质。换句话说,一个反应的反应物就像配方中的配料,而产品就像成品。找到∆H对于反应,首先确定其产物和反应物。例如,假设我们想找到氢和氧形成水的反应焓:2H2(氢)+O2(氧)→ 2H2O(水)。在这个方程式中,H2和O2是反应物,H2O是产物。
- 2测定反应物的总质量。接下来,找出反应物的质量。如果你不知道它们的质量,也无法在科学天平中称量反应物,你可以用它们的摩尔质量来计算它们的实际质量。摩尔质量是可以在标准周期表(针对单个元素)和其他化学资源(针对分子和化合物)中找到的常数。简单地将每个反应物的摩尔质量乘以用于计算反应物质量的摩尔数。在我们的水例子中,我们的反应物是氢气和氧气,它们的摩尔质量分别为2g和32g。由于我们使用了2摩尔氢(由H2旁边的方程式中的“2”系数表示)和1摩尔氧(由O2旁边的无系数表示),我们可以如下计算反应物的总质量:2×(2g)+1×(32g)=4g+32g=36g
- 3.找出产品的比热。接下来,找出你正在分析的产品的比热。每个元素或分子都有一个与之相关的特定热值:这些值是常数,通常位于化学资源中(例如,在化学教科书后面的表格中)。有几种不同的方法可以测量比热,但对于我们的公式,我们将使用以焦耳/克°C为单位的测量值。请注意,如果您的方程式有多个产物,则需要对用于生成每个产物的组分反应进行焓计算,然后将它们相加,以找到整个反应的焓。在我们的例子中,最终产物是水,其比热约为4.2焦耳/克摄氏度。
- 4找出反应后的温差。接下来,我们将找到∆T、 从反应前到反应后的温度变化。从最终温度(或T2)中减去反应的初始温度(或T1)以计算该值。与大多数化学工作一样,这里应该使用开尔文(K)温度(尽管摄氏度(C)会给出相同的结果)。在我们的例子中,假设我们的反应一开始是185K,但在完成时已经冷却到95K。在这种情况下,∆T的计算方法如下:∆T=T2–T1=95K–185K=-90K
- 5.使用公式∆H=m x s x∆T求解。一旦得到m,反应物的质量,s,产物的比热,和∆T、 温度从你的反应中变化,你就可以找到反应的焓。只需将您的值插入公式即可∆H=m x s x∆T和乘法求解。你的答案将以能量焦耳(J)为单位。对于我们的示例问题,我们会发现反应焓如下:∆H=(36g)×(4.2JK-1g-1)×(-90K)=-13608J
- 6确定你的反应是增加还是减少能量。最常见的原因之一是∆计算各种反应的H是为了确定反应是放热的(失去能量并放出热量)还是吸热的(获得能量并吸收热量)。如果你的最终答案是∆H为阳性,反应为吸热反应。另一方面,如果符号为负,则反应为放热反应。这个数本身越大,反应的放热或内热就越大。小心强烈的放热反应——这些反应有时意味着能量的大量释放,如果足够快,可能会导致爆炸。在我们的例子中,我们的最终答案是-13608 J。因为符号是负数,我们知道我们的反应是放热的。这是有道理的——H2和O2是气体,而产物H2O是液体。热气(以蒸汽的形式)必须以热量的形式向环境释放能量,以冷却到可以形成液态水的程度,这意味着H2O的形成是放热的。




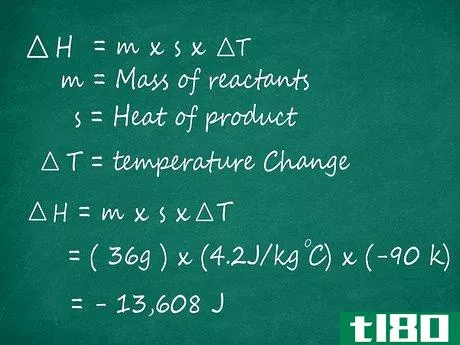
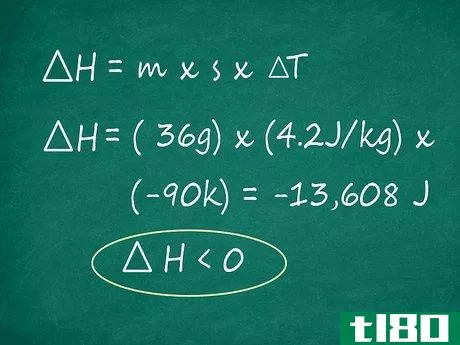
方法2方法2/3:估算焓
- 1使用键能估算焓。几乎所有的化学反应都涉及原子间键的形成或断裂。因为,在化学反应中,能量既不能被破坏也不能被创造,如果我们知道形成或破坏反应中形成(或破坏)的键所需的能量,我们可以通过将这些键能相加,高精度地估计整个反应的焓变。例如,让我们考虑H2+F2的反应→ 2HF。在这种情况下,分解H2分子中的H原子所需的能量是436 kJ/mol,而F2所需的能量是158 kJ/mol。最后,由H和F生成HF所需的能量是=-568 kJ/mol。我们将其乘以2,因为方程中的乘积是2HF,得到2×-568=-1136 kJ/mol。加起来,我们得到:436+158+-1136=-542 kJ/mol。
- 2使用生成焓来估算焓。设定生成焓∆H值,表示用于生成给定化学品的反应的焓变化。如果你知道在一个方程式中生成产物和反应物所需的生成焓,你可以将它们相加来估算焓,就像上面描述的键能一样。例如,让我们考虑C2H5OH+3O2的反应→ 2CO2+3H2O。在这种情况下,我们知道以下反应的生成焓:C2H5OH→ 2C+3H2+0.5O2=228 kJ/mol2C+2O2→ 2CO2=-394×2=-788 kJ/mol 3H2+1.5 O2→ 3H2O=-286×3=-858 kJ/mol,因为我们可以将这些方程相加得到C2H5OH+3O2→ 2CO2+3H2O,我们试图求出焓的反应,我们可以简单地将上述生成反应的焓相加,得到这个反应的焓,如下所示:228+-788+-858=-1418 kJ/mol。
- 3.逆转方程式时,别忘了切换符号。需要注意的是,当你用生成焓来计算一个反应的焓时,你需要反转生成焓的符号,只要你反转组分反应的方程式。换句话说,如果你必须把一个或多个生成反应方程式倒过来,才能让所有的产物和反应物正确地抵消,那么把你必须翻转的生成反应焓的符号倒过来。在上面的例子中,请注意,我们用于C2H5OH的生成反应是反向的。C2H5OH→ 2C+3H2+0.5O2显示C2H5OH分解,未形成。因为我们把方程颠倒过来,为了让所有的产物和反应物都能正确地抵消,我们把生成焓上的符号颠倒过来,得到228千焦/摩尔。实际上,C2H5OH的生成焓是-228千焦/摩尔。

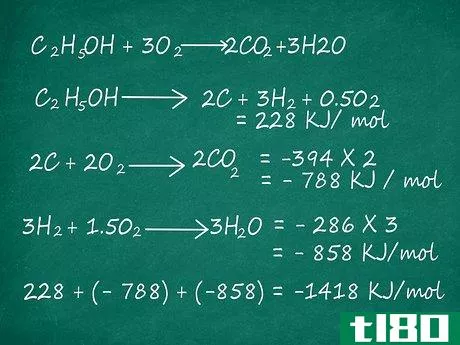

方法3方法3/3:通过实验观察焓变化
- 1拉起一个干净的容器并加水。通过一个简单的实验很容易看出焓的作用原理。为了确保实验中的反应不会受到任何外来污染,请清洁并消毒计划使用的容器。科学家使用称为量热计的特殊封闭容器来测量焓,但使用任何小玻璃罐或烧瓶都可以获得合理的结果。无论您使用何种容器,请用干净的室温自来水将其装满。你还需要在室内某个温度较低的地方进行反应。对于这个实验,你需要一个相当小的容器。我们将测试Alka-Seltzer对水的焓变化效应,因此用水量越少,温度变化越明显。
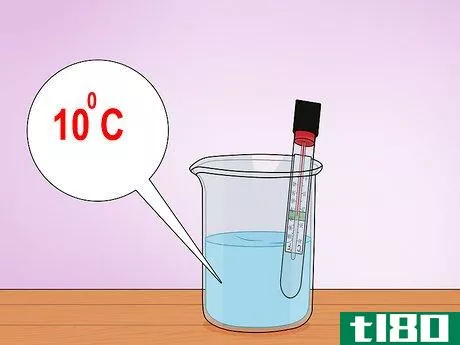
- 2将温度计插入容器中。抓起一个温度计,将其放在容器中,使温度读数端位于水位以下。取一个水的温度读数——出于我们的目的,水的温度将代表T1,反应的初始温度。假设我们测量了水的温度,发现它正好是10摄氏度。在几个步骤中,我们将使用这个样本温度读数来演示焓的原理。
- 3在容器中加入一片Alka Seltzer片剂。当你准备好开始实验时,将一片Alka Seltzer药片滴入水中。你应该注意到它立即开始冒泡和起泡。当药片溶解在水中时,它会分解成碳酸氢盐(HCO3-)和柠檬酸(以氢离子H+的形式反应)。这些化学物质在3HCO3反应中生成水和二氧化碳气体− + 3H+→ 3H2O+3CO2。
- 4反应结束时测量温度。在反应进行过程中监控反应——Alka Seltzer片剂应逐渐溶解。一旦平板电脑完成反应(或似乎已经慢到爬行),再次测量温度。水应该比以前稍微冷一点。如果温度更高,实验可能会受到外力的影响(例如,如果你所在的房间特别暖和)。在我们的示例实验中,假设平板电脑完成起泡后,水温为8摄氏度。
- 5估算反应的焓。在理想的实验中,当你将Alka Seltzer药片加入水中时,它会形成水和二氧化碳气体(后者可以被观察为起泡气泡),并导致水温下降。根据这一信息,我们预计反应是吸热的——也就是说,从周围环境中吸收能量的反应。溶解的液体反应物需要额外的能量才能跃迁到气体产物,因此它以热量的形式从周围环境(在这种情况下是水)吸收能量。这会使水温下降。在我们的示例实验中,加入Alka Seltzer后,水温下降了2度。这与我们预期的温和吸热反应是一致的。



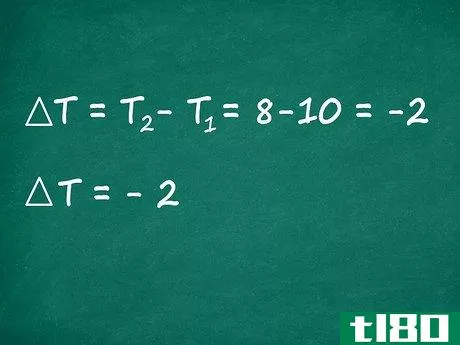
- 这些计算是用开尔文(K)来完成的,开尔文(K)是一种温度测量的刻度,就像摄氏度一样。要在摄氏度和开尔文之间转换,只需加或减273度:K=°C+273。
- 发表于 2022-05-18 11:35
- 阅读 ( 46 )
- 分类:教育
你可能感兴趣的文章
键焓(bond enthalpy)和晶格焓(lattice enthalpy)的区别
键焓和晶格焓的关键区别在于,键焓是分解化学键所需的能量,而晶格能是从气态的阳离子和阴离子形成一摩尔离子化合物所需的能量。 这两个术语都描述了系统与其周围环境之间的能量交换。键焓与晶格焓相反。键焓解释...
- 发布于 2020-10-15 02:15
- 阅读 ( 455 )
生成热(heat of formation)和反应热(heat of reaction)的区别
...一摩尔物质过程中的焓变化,而反应热是在恒压下发生的化学反应过程中焓的变化。 生成热和反应热是化学反应的重要焓值。我们将这些术语定义为标准条件,即标准压力和标准温度。在这里,热或焓是在化学反应过程中从系...
- 发布于 2020-10-18 06:22
- 阅读 ( 534 )
自由能(free energy)和焓(enthalpy)的区别
...是两个热力学术语,用来解释热能与热力学系统中发生的化学反应之间的关系。自由能或热力学自由能是一个热力学系统能做的功的量。换言之,自由能是热力学系统中进行热力学功的可用能量。另一方面,焓是一个热力学量,...
- 发布于 2020-10-19 11:40
- 阅读 ( 626 )
平衡方程(balanced equation)和净离子方程(net ionic equation)的区别
关键区别-平衡方程式与净离子方程式 所有的化学反应都可以写成一个方程式。这个方程的组成部分包括反应物及其物理状态,一个表示反应方向的箭头,以及反应与其物理状态的产物。如果使用了任何特殊条件,它们也会简...
- 发布于 2020-10-20 16:30
- 阅读 ( 745 )
化学的(chemical)和物理反应(physical reaction)的区别
化学的(chemical)和物理反应(physical reaction)的区别 化学反应和物理反应是物质的两种变化,化学反应和物理反应的关键区别在于,当一种物质发生化学反应时,它不再是反应前的原始化合物,而,经过物理反应的物质在其状态...
- 发布于 2020-10-28 21:10
- 阅读 ( 514 )
焓(enthalpy)和熵(entropy)的区别
...统的无序程度。 总结 - 焓(enthalpy) vs. 熵(entropy) 焓和熵是化学反应中常用的热力学术语。焓和熵之间的关键区别在于,焓是在恒定压力下进行的传热,而熵给出了系统随机性的概念。 引用 1歌词。“焓”,化学剧本,国家科学基...
- 发布于 2020-11-04 20:59
- 阅读 ( 1883 )
焓(enthalpy)和热(heat)的区别
焓和热之间的关键区别在于,焓是在恒压下化学反应过程中传递的热量,而热是能量的一种形式。 为了研究化学,我们把宇宙分成两个部分:一个系统和一个周围。系统是我们调查的对象,其余的是周围的。热和焓是描述系...
- 发布于 2020-11-05 19:40
- 阅读 ( 894 )
原子化焓(enthalpy of atomisation)和键裂解(bond dissociation)的区别
原子化焓和键离解焓之间的关键区别在于,原子化焓描述了将分子分离成原子所需的能量,而键离解焓描述了分子中化学键的离解。 有时,如果存在简单键,一些简单化合物的原子化焓和键解离焓是相同的。这是因为,在简...
- 发布于 2021-03-04 20:07
- 阅读 ( 960 )
键能(bond energy)和键离解能焓(bond dissociation energy enthalpy)的区别
键能与键离解能(焓) 键能是存在于相同类型原子之间的气相键离解能(通常在298 K的温度下)的平均值。然而,键能和键离解能是不一样的。键离解能是共价键(也称为分子键,是两个非金属原子之间的化学键,涉及这些原子...
- 发布于 2021-06-26 10:13
- 阅读 ( 482 )
如何计算向心力(calculate centripetal force)
...h cases. The only difference is that the force named for the car is the reaction force between the car’s tyres and the road surface, whereas for the aeroplane, is the “Lift” force from the wings. In both cases, refers to the mass of the car/aeroplane. How to Calculate Centripetal For...
- 发布于 2021-06-27 03:05
- 阅读 ( 198 )