关键区别——理想气体定律与范德瓦尔斯方程
理想气体定律是一个基本定律,而范德瓦尔斯方程是理想气体定律的修正版本。理想气体定律与范德瓦尔斯方程的主要区别在于,理想气体定律方程适用于理想气体,而范德瓦尔斯方程既适用于理想气体,也适用于实际气体。
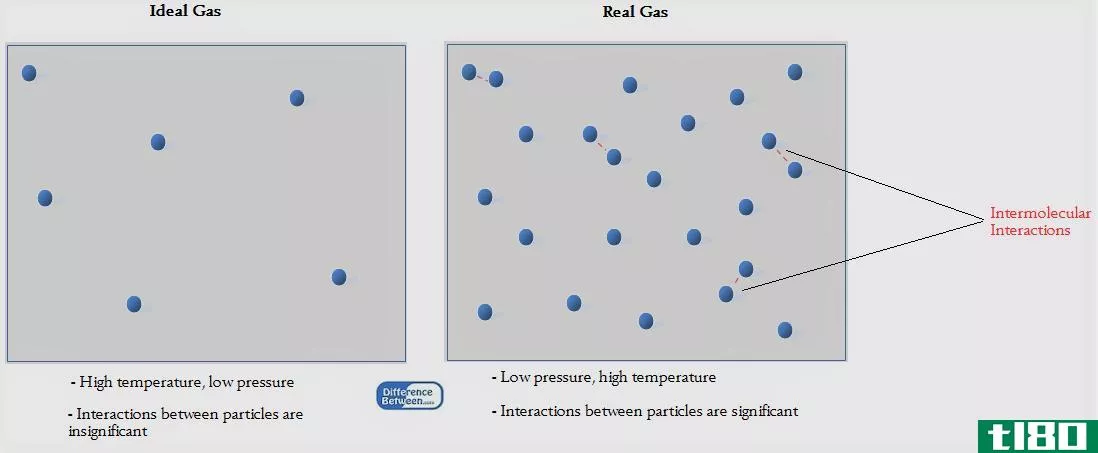
气体是存在于物质气相的化合物。为了了解气体的行为和性质,我们使用气体定律。这些气体定律用来描述理想气体的性质。理想气体是一种假设的气体化合物,它具有独特的特性,即理想气体分子之间没有引力。然而,真实气体与理想气体有很大的不同。但在适当的条件下(高温和低压),一些真实的气体表现为理想气体。因此,在将气体定律用于实际气体之前,需要对其进行修改。
目录
1. 概述和主要区别
2. 理想气体定律是什么
3. 范德瓦尔斯方程是什么
4. 并列比较-理想气体定律与范德瓦尔斯方程的表格形式
5. 摘要
什么是理想气体定律方程(ideal gas law equation)?
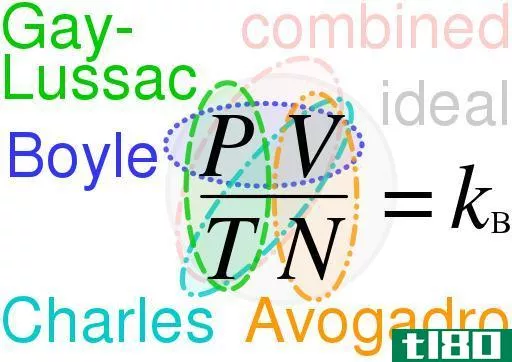
理想气体定律方程是化学中的一个基本定律。理想气体定律表明,理想气体的压力和体积的乘积与温度和理想气体的气体粒子数的乘积成正比。理想气体定律方程如下所示。
PV=NkT
式中P为压力,V为体积,N为气体颗粒数,T为理想气体的温度。“k”是一个比例常数,称为玻尔兹曼常数(该常数的值为1.38x10-23j/k)。然而,这个方程最常见的形式如下。
PV=nRT
其中P是压力,V是体积,n是气体的摩尔数,T是气体的温度。R被称为通用气体常数(8.314 Jmol-1K-1)。这个方程可以得到如下公式。
玻尔兹曼常数(k)=R/N
把这个关系应用到基本方程中,
PV=N x(R/N)x T
PV=RT
对于“n”摩尔数,
PV=nRT
什么是范德瓦尔斯方程(van der waals equation)?
范德华方程是理想气体定律的修正版。这个方程既适用于实际气体,也适用于理想气体。理想气体定律不能适用于实际气体,因为气体分子的体积与真实气体的体积相比是相当大的,并且真实气体分子之间存在着吸引力(理想气体分子的体积与总体积相比微不足道,气体分子之间没有吸引力)。范德华方程如下所示。
(P+a{n/V}2)({V/n}-b)=nRT
这里,“a”是一个常数,它取决于气体的类型,b也是一个常数,它给出每摩尔气体的体积(被气体分子占据)。它们被用来作为理想定律方程的修正。
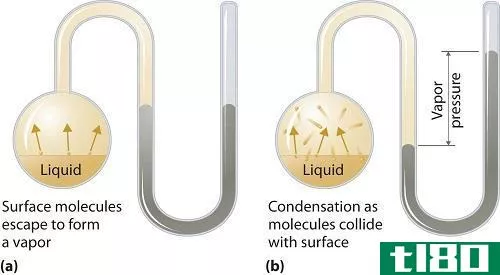
图01:真实气体的行为与理想气体的不同
-
Volume Correction
真实气体分子的体积是不可忽略的(与理想气体不同)。因此,进行了体积校正。b-V为体积修正。这给出了气体分子可移动的实际体积(实际体积=总体积-有效体积)。
-
Pressure Correction
气体的压力是气体分子施加在容器壁上的压力。由于真实气体分子之间存在引力,压力与理想状态下的压力不同。然后进行压力校正。(P+a{n/V}2)是压力修正。(理想压力=观测压力+压力校正)。
理想气体定律(ideal gas law)和范德瓦尔斯方程(van der waals equation)的区别
| 理想气体定律与范德瓦尔斯方程 | |
| 理想气体定律方程是化学中的一个基本定律。 | 范德华方程是理想气体定律的修正版。 |
| 方程式 | |
| 理想气体定律方程为PV=NkT | 范德华方程是(P+a{n/V}2)({V/n}-b)=nRT |
| 自然 | |
| 理想气体定律方程不是修正版。 | 范德华方程是一个修正的版本,它对真实气体的压力和体积作了一些修正。 |
| 组件 | |
| 给出了理想气体的理想气体定律方程。 | 范德华方程既适用于理想气体,也适用于实际气体。 |
总结 - 理想气体定律(ideal gas law) vs. 范德瓦尔斯方程(van der waals equation)
气态是物质的三个主要相之一。气体的行为和性质可以用气体定律来确定或预测。理想气体定律是适用于理想气体的基本定律。但考虑实际气体时,理想气体定律方程需要修正。理想气体定律与范德瓦尔斯方程的区别在于,理想气体给出了理想气体定律方程,而范德瓦尔斯方程既适用于理想气体,也适用于实际气体。
引用
1.“真实气体”,《化学歌词》,歌词,2016年2月1日。这里有2.Nave,C R.“范德瓦尔斯状态方程”,超物理学,2016年。这里有3个。波尔多,苏巴什。“范德瓦尔斯方程”科学总部。埃德·罗德·皮尔斯。2013年2月18日。2018年3月22日。此处提供
2.Nave,C R.“范德瓦尔斯状态方程”,《超物理学》,2016年。
3.波尔多,苏巴什。“范德瓦尔斯方程”科学总部。埃德·罗德·皮尔斯。2013年2月18日。2018年3月22日。