关键区别-离子偶极与偶极-偶极力
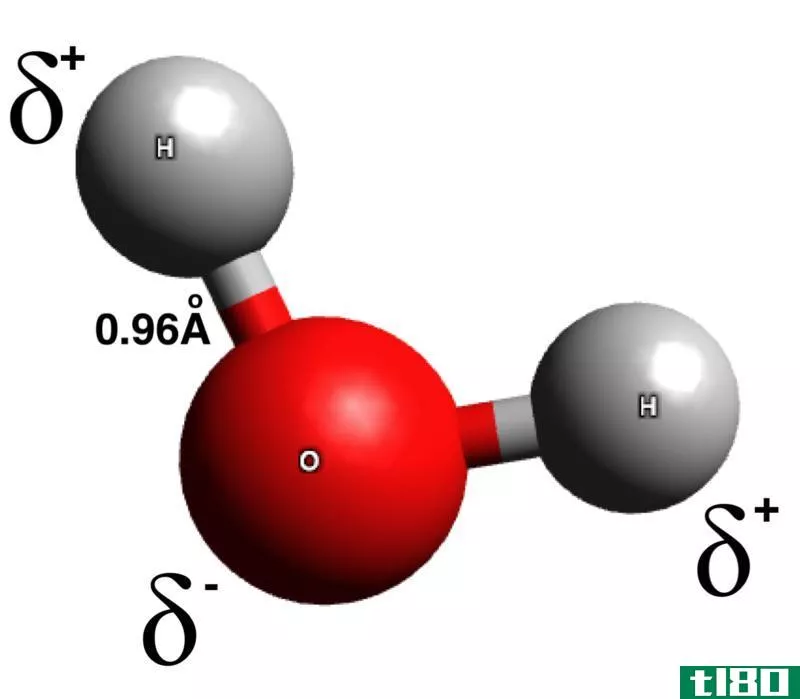
分子间作用力是不同分子之间存在的吸引力。离子偶极力和偶极-偶极力是分子间作用力的两种形式。其他一些分子间力的例子包括离子诱导的偶极力、氢键和范德华力。这些力是静电吸引,因为分子是基于它们的电荷被吸引的。离子偶极力与偶极-偶极力的关键区别在于离子种类与极性分子之间存在离子偶极力,而极性分子之间存在偶极-偶极力。
目录
1. 概述和主要区别
2. 什么是离子偶极力
3. 什么是偶极-偶极力
4. 偶极离子力与偶极离子的相似性
5.并列比较-以表格形式显示的离子-偶极和偶极-偶极力
6. 摘要
什么是离子偶极力(ion dipole forces)?
离子偶极力是离子种类和极性之间的吸引力分子。那个离子物种可以是阴离子(带负电的物种)或阳离子(带正电荷的物种)。极性分子是指由于分子中的原子。电负性是吸引电子的能力。当一个具有高电负性的原子与一个具有低电负性的原子结合时,键电子被具有高电负性的原子吸引(然后它得到部分负电荷),从而使电负性较低的原子具有部分正电荷。这种电荷分离状态称为极化,分子称为极性分子。
离子偶极力大于偶极-偶极力。这是因为这种类型的分子间作用力涉及到离子物种,与极性分子相比,这些离子具有更高的电荷。离子偶极力甚至比氢键强。这种相互作用是由于离子和偶极子之间的静电相互作用而发生的。
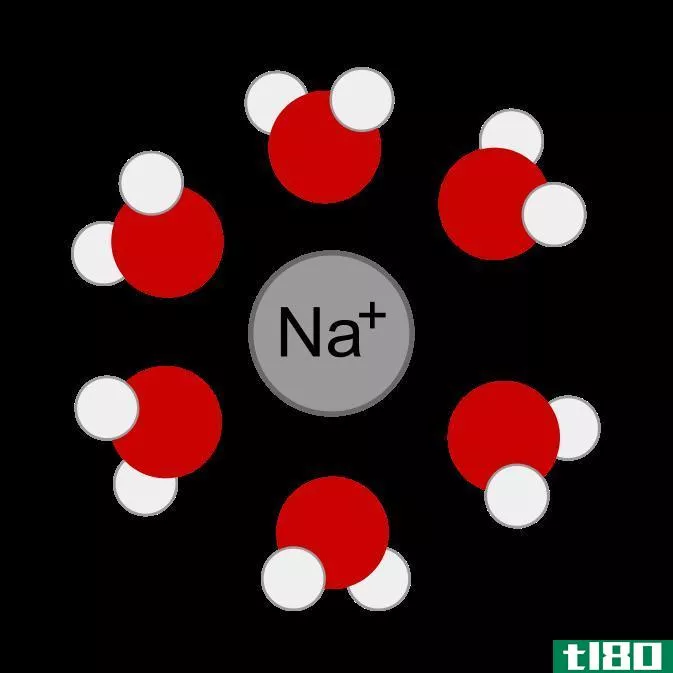
图01:由于金属离子和水分子(偶极子)之间的吸引力,金属离子发生水合作用
离子偶极力的一个子类是离子诱导的偶极力,它涉及非极性分子而不是极性分子。非极性分子没有偶极子(没有电荷分离)。离子的电荷通过扭曲非极性分子的电子云使其极化。
什么是偶极-偶极力(dipole dipole forces)?
偶极-偶极力是发生在极性分子之间的分子间力。这些是静电力。当形成这种力时,极性分子趋向于排列,这样分子之间的吸引力通过降低势能而达到最大。这种排列也减少了分子间的排斥。

图02:极性HCl分子之间的吸引力
当考虑一系列摩尔质量相似的化合物(分子间存在偶极-偶极相互作用力)时,偶极-偶极力的强度随着极性的增加而增加。这是因为当极性很高时,意味着电荷分离度很高。当分子具有高电荷分离(同一分子中的高电荷正负端)时,它倾向于强烈地吸引相反的电荷。这也会导致化合物的沸点升高。偶极-偶极力越大,沸点越大。
离子偶极(ion dipole)和偶极-偶极力(dipole dipole forces)的共同点
- 离子偶极力和偶极-偶极力都是分子间相互作用的类型
- 离子偶极力和偶极-偶极力都是静电力
离子偶极(ion dipole)和偶极-偶极力(dipole dipole forces)的区别
| 偶极离子力与偶极离子力 | |
| 离子偶极力是离子物种和极性分子之间的吸引力。 | 偶极-偶极力是发生在极性分子之间的分子间力。 |
| 力量 | |
| 离子偶极力比氢键和偶极-偶极力强。 | 偶极-偶极力弱于氢键和离子偶极力。 |
| 组件 | |
| 离子偶极力产生于离子(阳离子或阴离子)和极性分子之间。 | 极性分子之间产生偶极-偶极力。 |
总结 - 离子偶极(ion dipole) vs. 偶极-偶极力(dipole dipole forces)
离子偶极力和偶极-偶极力是存在于阳离子、阴离子和极性分子等不同化学物种之间的分子间作用力。极性分子是具有偶极子(电荷分离)的共价化合物。极性分子在同一分子中有一个带正电荷的末端和一个带负电的终端。因此,这些终端可能具有带相反电荷的静电吸引物。离子偶极力和偶极-偶极力的区别在于离子物种和极性分子之间存在离子偶极力,而极性分子之间存在偶极-偶极力。
引用
1.“11.3:偶极-偶极力”,化学剧本,歌词,2018年2月11日。这里有2。偶极-偶极力。此处提供3.“分子间作用力”,维基百科,维基媒体基金会,2018年3月14日。此处提供
2.偶极-偶极力。
3.“分子间力量”,维基百科,维基媒体基金会,2018年3月14日。