偶极-偶极对色散|偶极-偶极相互作用对色散力
偶极-偶极相互作用和色散力是分子间的相互吸引。有些分子间的作用力很强,有些则很弱。然而,所有这些分子间的相互作用都比分子内的力弱,如共价键或离子键。这些键决定了分子的行为。
什么是偶极-偶极相互作用?
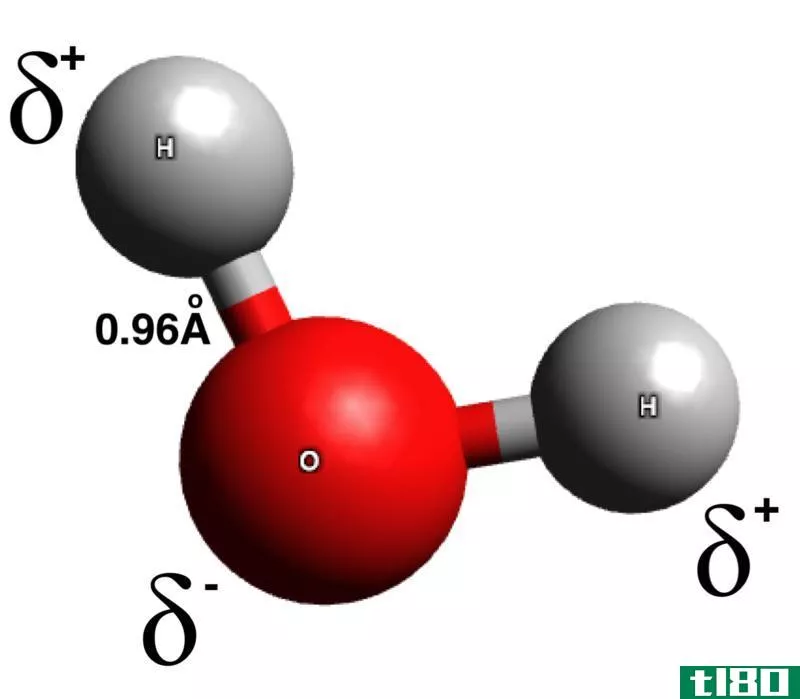
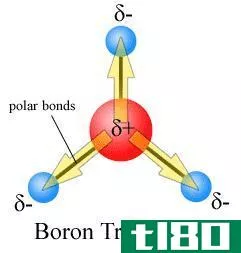
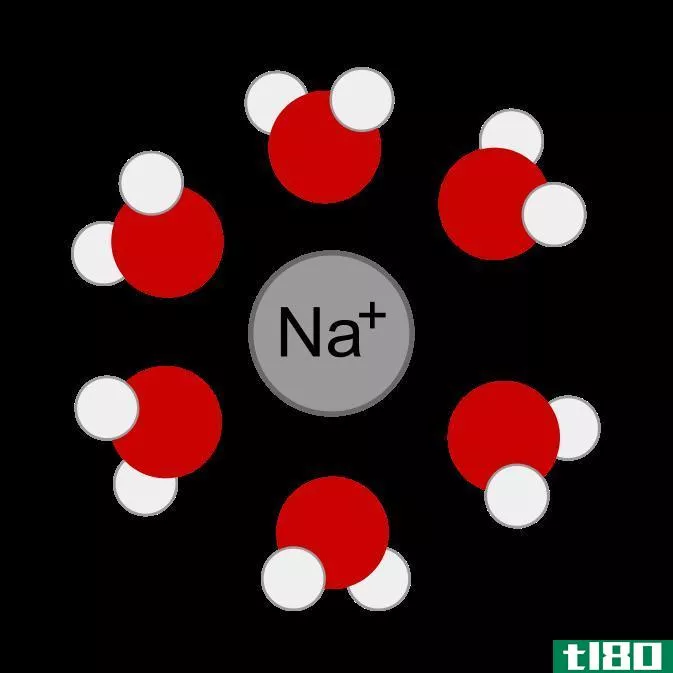
极性是由于电负性的不同而产生的。电负性是衡量原子在键中吸引电子的程度。通常用波林标度来表示电负性值。在周期表中,电负性值的变化是有规律的。氟的电负性最高,根据Pauling标度,为4。从左到右经过一段时间,电负性值增加。因此,卤素在一个周期内具有较大的电负性值,而第1族元素的电负性值相对较低。在小组中,电负性值降低。当形成键的两个原子不同时,它们的电负性往往不同。因此,与参与形成键的另一个原子相比,键-电子对被一个原子拉得更大。这将导致两个原子之间的电子分布不均。由于电子的不均匀共享,一个原子带着轻微的负电荷,而另一个原子则带着轻微的正电荷。在这种情况下,我们说原子获得了部分负电荷或正电荷(偶极子)。电负性高的原子带轻微的负电荷,电负性低的原子带轻微的正电荷。当一个分子的正端和另一个分子的负端靠近时,两个分子之间就会形成静电相互作用。这就是所谓的偶极-偶极相互作用。
什么是分散力?
这也被称为伦敦分散部队。对于分子间的吸引,应该有电荷分离。有一些对称分子,如H2,Cl2,在那里没有电荷分离。然而,这些分子中的电子是不断运动的。因此,如果电子向分子的一端移动,分子内部会发生瞬间电荷分离。带电子的一端会带暂时的负电荷,而另一端会带正电荷。这些临时偶极子可以在相邻的分子中诱导偶极子,然后在相反的两极之间发生相互作用。这种相互作用被称为瞬时偶极诱导偶极相互作用。这是一种范德瓦尔斯力,又称伦敦分散力。
| 偶极-偶极相互作用和色散力有什么区别?•两个永久偶极子之间发生偶极-偶极相互作用。相反,色散力发生在没有永久偶极子的分子中。•两个非极性分子可以具有色散力,两个极性分子将具有偶极-偶极相互作用。•色散力弱于偶极-偶极相互作用。•键的极性差异和电负性差异影响偶极-偶极相互作用强度。分子结构、大小和相互作用的数量影响分散力的强度。 |