如何计算化学中的百分产率(calculate percent yield in chemistry)
第1部分第1部分,共3部分:寻找极限反应物
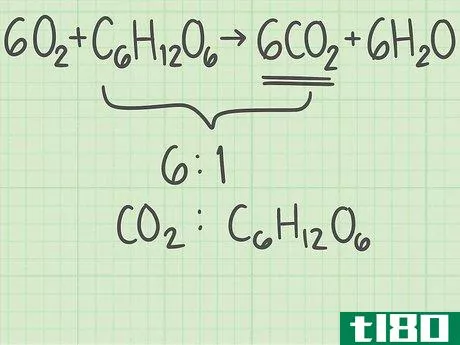
- 1从平衡的化学方程式开始。化学方程式描述了反应物(左侧)反应形成产物(右侧)。有些问题会给你这个等式,而另一些问题会让你自己写出来,比如一个单词题。由于原子在化学反应中不会产生或破坏,所以每个元素的左右两侧原子数应该相同。例如,氧和葡萄糖可以反应形成二氧化碳和水:6O2+C6H12O6{\displaystyle 6O\U2}+C\U6}H\U12}O\U6}→ 6CO2+6H2O{\6CO_{2}+6H_{2}O}每侧正好有6个碳(C)原子、12个氢(H)原子和18个氧(O)原子。方程是平衡的。如果你被要求自己平衡一个等式,请阅读本指南。
- 2计算每种反应物的摩尔质量。查一下化合物中每个原子的摩尔质量,然后把它们加在一起,得到该化合物的摩尔质量。对化合物的单个分子进行此操作。例如,一个氧分子(O2{\O{2}})包含两个氧原子。氧的摩尔质量约为16克/摩尔(你可以在周期表上找到更精确的值)2个氧原子x 16 g/mol/原子=32 g/mol O2{\O{2}。另一种反应物葡萄糖(C6H12O6{\cU6}H{12}O{6})的摩尔质量为(6个原子cx12 g C/mol)+(12个原子hx1 g H/mol)+(6个原子ox16 g O/mol)=180 g/mol。
- 3将每种反应物的量从克换算为摩尔。现在是时候看看你正在研究的具体实验了。记下每种反应物的量,单位为克。将该值除以该化合物的摩尔质量,将量转换为摩尔。例如,假设你从40克氧气和25克葡萄糖开始。40克氧气{\O{2}/(32克/摩尔)=1.25摩尔氧气。25g C6H12O6{\显示型C{6}H{12}O{6}}/(180 g/mol)=约0.139摩尔葡萄糖。
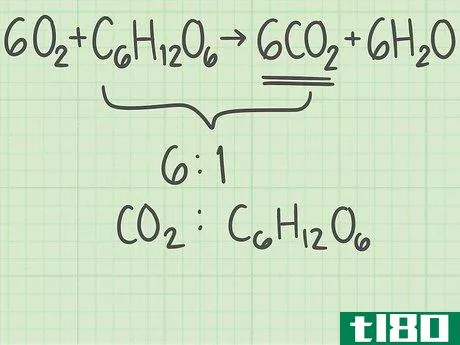
- 4找出你反应的比例。对于一个物质,它可以是原子数或原子数的23倍。你现在知道你开始时每个反应物的分子数了。将一种反应物的摩尔数除以另一种反应物的摩尔数,得出两种分子的比例。你从1.25摩尔氧气和0.139摩尔葡萄糖开始。氧与葡萄糖分子的比率为1.25/0.139=9.0。这意味着每1个葡萄糖分子中就有9个氧分子。
- 5找到反应的理想比例。回到你之前写下的平衡方程式。这个平衡方程式告诉你分子的理想比率:如果你使用这个比率,两种反应物将同时用完。方程的左边是6O2+C6H12O6{\displaystyle 6O{2}+C{6}H{12}O{6}。这些系数告诉你有6个氧分子和1个葡萄糖分子。该反应的理想比例为6氧/1葡萄糖=6.0。确保你列出的反应物的顺序与你列出的其他比例相同。如果你用氧/葡萄糖作为1,用葡萄糖/氧气作为另一个,你的下一个结果将是错误的。
- 6比较比率,找出限制反应物。在一个化学反应中,一种反应物比其他反应物先用完。反应中生成的产物数量受试剂的限制。比较你计算的两个比率,以确定极限反应物:如果实际比率大于理想比率,那么你有比你需要的更多的顶部反应物。比率中的底部反应物是限制反应物。如果实际比率小于理想比率,你没有足够的顶部反应物,所以它是限制反应物。在上述示例中,实际氧/葡萄糖比率(9.0)大于理想比率(6.0)。底部的反应物葡萄糖必须是限制性反应物。











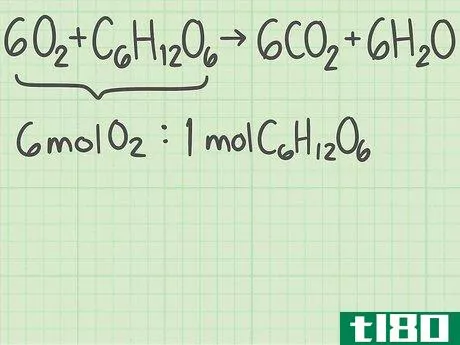
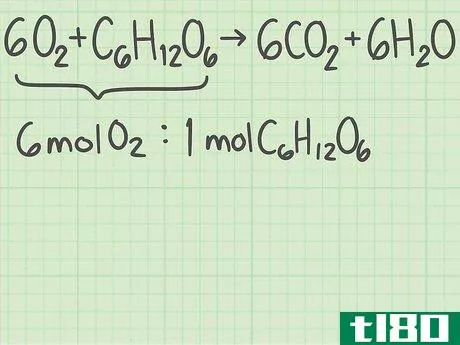

第2部分第2部分(共3部分):计算理论产量
- 1确定你想要的产品。化学方程式的右边列出了反应生成的产物。每种产物都有一个理论产率,也就是说,如果反应完全有效,你期望得到的产物量。继续上面的例子,您正在分析反应6O2+C6H12O6{\displaystyle 6O{2}+C{6}H{12}O{6}→ 6CO2+6H2O{\6CO{2}+6H{2}O}。右边列出了两种产品,二氧化碳和水。让我们计算二氧化碳的产率,CO2{\displaystyle CO{2}}。
- 2写下限制反应物的摩尔数。实验的理论产量是在完美条件下产生的产品量。为了计算这个值,从限制反应物的摩尔量开始。(上述寻找限制性反应物的说明中描述了该过程。)在上面的例子中,你发现葡萄糖是限制性反应物。你还计算出你从0.139摩尔葡萄糖开始。
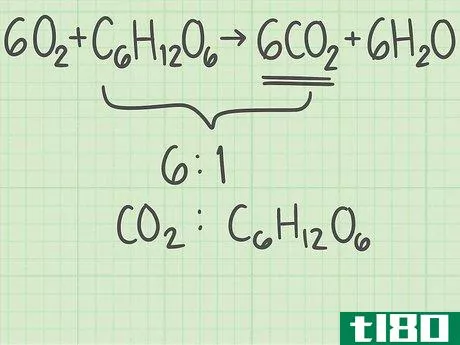
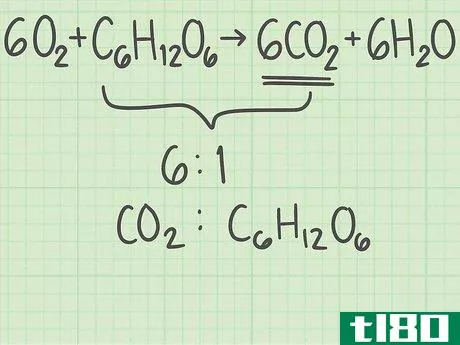
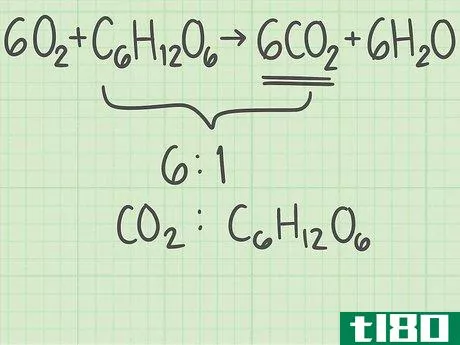
- 3找出产品中分子与反应物的比例。回到平衡方程式。将所需产物的分子数除以限制反应物的分子数。你的平衡方程是6O2+C6H12O6{\displaystyle 6O{2}+C{6}H{12}O{6}→ 6CO2+6H2O{\6CO{2}+6H{2}O}。你想要的产品有6个分子,二氧化碳(CO2{\displaystyle CO{2}})。有一个限制性反应物的分子,葡萄糖(C6H12O6{\displaystylec\u6}H\u12}O\u6})。二氧化碳与葡萄糖的比率为6/1=6。换句话说,这个反应可以从1个葡萄糖分子中产生6个二氧化碳分子。
- 4将该比率乘以反应物的摩尔量。答案是所需产物的理论产率,单位为摩尔。你从0.139摩尔葡萄糖开始,二氧化碳和葡萄糖的比例是6。二氧化碳的理论产率为(0.139摩尔葡萄糖)x(6摩尔二氧化碳/摩尔葡萄糖)=0.834摩尔二氧化碳。
- 5将结果转换为克。用摩尔数乘以该化合物的摩尔质量,得到理论产率(克)。在大多数实验中,这是一个更方便的单位。例如,CO2的摩尔质量约为44 g/mol。(碳的摩尔质量约为12 g/mol,氧的摩尔质量约为16 g/mol,因此总质量为12+16+16=44。)乘以0.834摩尔二氧化碳x 44克/摩尔二氧化碳=~36.7克。实验的理论产率为36.7克二氧化碳。
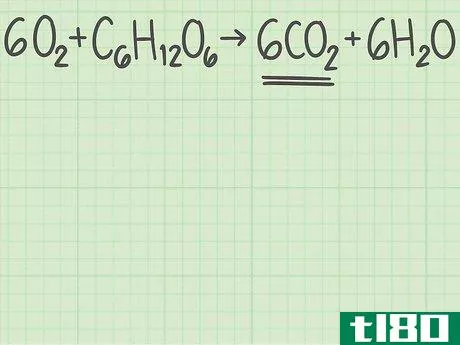
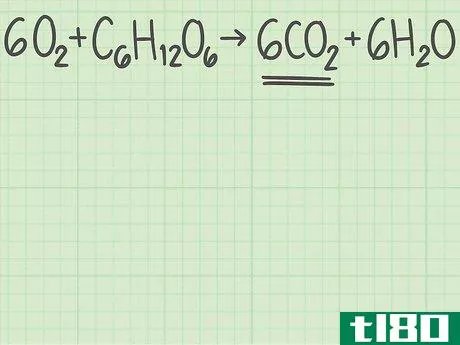
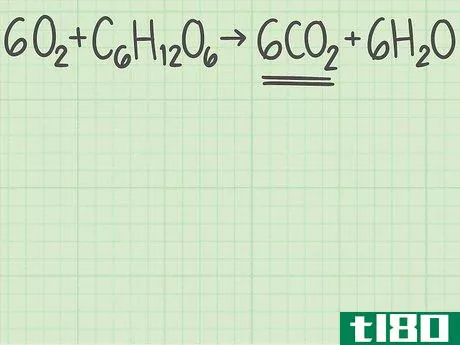
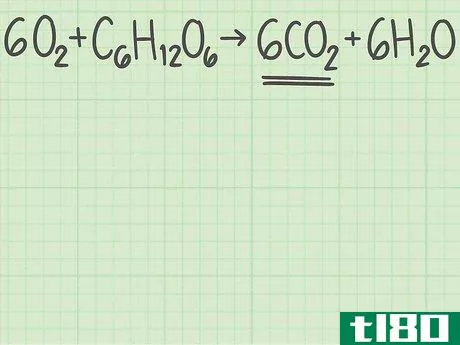
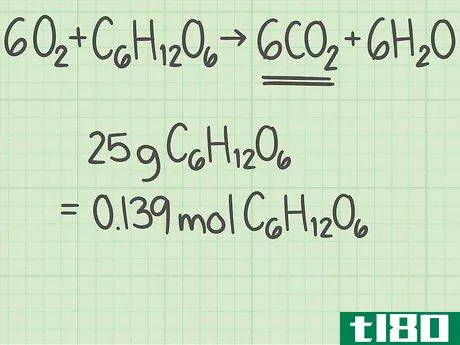
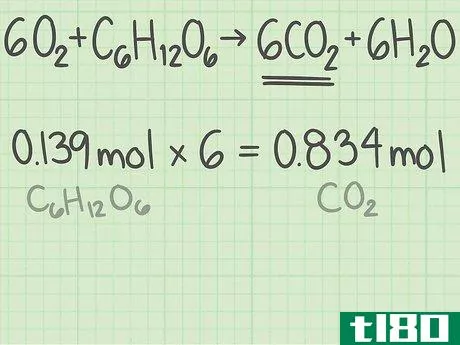
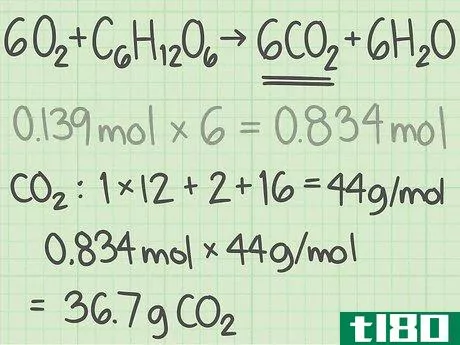
第3部分第3部分,共3部分:计算收益率
- 1了解百分之十的收益率。你计算的理论收益率假设一切都很顺利。在实际的实验中,这永远不会发生:污染物和其他不可预测的问题意味着你的一些反应物将无法转化为产物。这就是为什么化学家使用3个不同的概念来指代产率:理论产率是实验所能产生的最大产品量。实际收益率是您创建的实际金额,直接在天平上测量。收益率=实际收益率=理论收益率∗100%{\displaystyle{\frac{ActualYield}{theory-eticalyield}}*100\%。例如,50%的收益率意味着你最终得到了理论最大值的50%。
- 2.写下实验的实际产量。如果你自己做实验,从你的反应中收集纯化的产物,并在天平上称重以计算其质量。如果你在做家庭作业或其他人的笔记,应该列出实际收益率。假设我们的实际反应产生29克二氧化碳。
- 3将实际产量除以理论产量。确保两个值使用相同的单位(通常为克)。你的答案是单位减去比率。实际收率为29克,而理论收率为36.7克。29g36。7g=0.79{\displaystyle{\frac{29g}{36.7g}=0.79}。
- 4乘以100转换成一个百分比。答案是收益率。0.79x100=79,因此实验的产率为79%。你创造了79%的最大二氧化碳量。






- 有些学生把百分比收益率(你从总的可能数量中获得了多少)和百分比误差(实验结果与预期结果相差多远)混为一谈。正确的百分比收益率公式是ActualYieldTheoreticalYieldx100{\displaystyle{\frac{ActualYield}{TheoreticalYield}}}x100}。如果你减去2个收益率,你使用的是误差百分比公式。
- 如果你得到的结果大不相同,请检查你的单位。如果你的实际产量与理论产量相差一个数量级或更多,你可能在计算中使用了错误的单位。重复计算,并记录每一步的单位。
- 如果你的百分产率大于100%(并且你确信你的计算是正确的),其他物质已经污染了你的产品。净化产品(如通过干燥或过滤)并再次称重。
- 发表于 2022-05-18 09:23
- 阅读 ( 111 )
- 分类:教育
你可能感兴趣的文章
质量百分比(mass percent)和成分百分比(percent composition)的区别
...与百分比组成的表格形式 5. 摘要 什么是质量百分比(mass percent)? 质量百分比是混合物中成分质量的百分比。该术语描述了所需成分的质量与混合物总质量乘以100得到的百分比值。测定公式如下: 质量百分比=(组分质量/混合物...
- 发布于 2020-10-15 18:19
- 阅读 ( 517 )
定性的(qualitative)和化学定量分析(quantitative analysis in chemistry)的区别
主要区别——化学中的定性分析与定量分析 化学中的定性和定量分析是化学中用于定性和定量测定样品化学成分的分析技术的主要类型。化学中定性分析和定量分析的关键区别在于,化学中的定性分析给出了样品中不同化学...
- 发布于 2020-10-19 08:40
- 阅读 ( 502 )
原子经济(atom economy)和百分比收益率(percentage yield)的区别
...物即使在反应完成后仍保留,因为它们是多余的试剂。 如何找到限制试剂? 例:让我们考虑一下Al(14g)和Cl2(4.25g)气体之间的反应。最终产品是三氯化铝。 2Al+3Cl2→2AlCl3 铝的摩尔数=14/26.98=0.52摩尔 Cl2的摩尔数=4.25/70.90=0.06摩...
- 发布于 2020-10-19 08:47
- 阅读 ( 874 )
丰度百分比(percent abundance)和相对丰度(relative abundance)的区别
...表示的丰度百分比与相对丰度 6. 摘要 什么是丰度百分比(percent abundance)? 丰度百分比是一种元素所有自然存在的同位素的百分比。同位素是同一元素的原子,原子序数相同,但质量数不同。这意味着同位素是原子核中质子数相...
- 发布于 2020-10-19 10:36
- 阅读 ( 1374 )
每日应用程序交易:在今天的应用程序交易中免费获得android的percent calculator pro
...程序折扣,以及一些值得注意的提到那些正在**。最好的PercentCalculator-Pro(亚马逊应用商店)以前是1美元,现在是免费的。百分比计算器-专业的Android把各种现实世界中的百分比问题,只要几次点击。用最少的困惑和思考算出百...
- 发布于 2021-05-26 16:49
- 阅读 ( 162 )
如何计算极限反应物和理论产率(calculate limiting reactant and theoretical yield)
...反应物耗尽时产生的产物量。这个化学问题的实例展示了如何确定极限反应物和计算化学反应的理论产率。 极限反应物与理论产率问题 你会得到以下反应: 2氢(克)+氧(克)→ 2 H2O(升) 计算: A.摩尔H2与摩尔O2b的...
- 发布于 2021-09-06 21:37
- 阅读 ( 527 )
为什么化学很重要?
为什么化学很重要?如果你学化学或教化学,你会经常被要求回答这个问题。说化学很重要很容易,因为任何东西都是由化学物质制成的,但为什么化学是日常生活的重要组成部分,为什么每个人都应该了解基础化学,还有很...
- 发布于 2021-09-07 00:35
- 阅读 ( 301 )
化学中的理论产率定义
...产量和理论产量之间的比率通常以百分比产量表示: Percent yield = Mass of actual yield / Mass of theoretical yield x 100 percent 如何计算理论产量 通过确定平衡化学方程式中的极限反应物,发现了理论产率。为了找到它,第一步是平衡...
- 发布于 2021-09-07 01:19
- 阅读 ( 512 )
什么是化学系的鼹鼠?(a mole in chemistry?)
摩尔只是一个测量单位。事实上,它是国际单位制(SI)的七个基本单位之一。当现有装置不足时,就发明了装置。化学反应通常发生在使用克数没有意义的水平上,但使用原子/分子/离子的绝对数也会令人困惑。因此,科学家...
- 发布于 2021-09-08 07:33
- 阅读 ( 335 )
如何在化学中找到poh(find poh in chemistry)
有时会要求您计算pOH,而不是pH。下面是对pOH定义的回顾和计算示例。 关键要点:如何计算poh pH值表示酸度或氢离子浓度,而pOH表示碱度或氢氧化物离子浓度。 如果你知道pH,很容易计算pOH,因为pH+pOH=14。 有时,您需要根...
- 发布于 2021-09-09 17:06
- 阅读 ( 329 )