什么是化学中的速率常数?(the rate constant in chemistry?)
速率常数是化学动力学速率定律中的一个比例因子,它将反应物的摩尔浓度与反应速率联系起来。它也被称为反应速率常数或反应速率系数,在方程式中用字母k表示。

关键收获:速率常数
- 速率常数k是一个比例常数,表示反应物摩尔浓度与化学反应速率之间的关系。
- 利用反应物的摩尔浓度和反应顺序,可以通过实验找到速率常数。或者,可以使用Arrhenius方程计算。
- 速率常数的单位取决于反应的顺序。
- 速率常数不是真常数,因为它的值取决于温度和其他因素。
速率常数方程
写速率常数方程有几种不同的方法。一般反应有一种形式,一级反应和二级反应。另外,你可以用阿累尼乌斯方程求出速率常数。
对于一般化学反应:
aA+bB→ cC+dD
化学反应速率可计算为:
速率=k[A]A[B]B
重新排列术语,速率常数为:
速率常数(k)=速率/([A]A[B]A)
这里,k是速率常数,[A]和[B]是反应物A和B的摩尔浓度。
字母a和b代表相对于a的反应顺序和相对于b的反应顺序。它们的值是通过实验确定的。它们一起给出了反应的顺序,n:
a+b=n
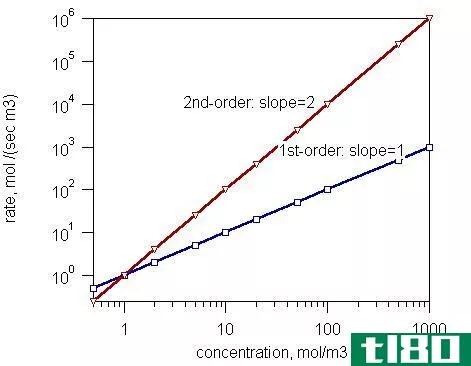
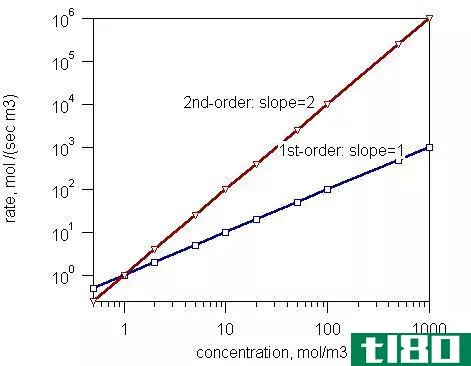
例如,如果将A的浓度加倍使反应速率加倍或将A的浓度加倍使反应速率加倍,则反应相对于A为一级反应。速率常数为:
k=速率/[A]
如果将A的浓度增加一倍,反应速率增加四倍,反应速率与A浓度的平方成正比。相对于A,反应为二级反应。
k=比率/[A]2
阿累尼乌斯方程的速率常数
速率常数也可用阿累尼乌斯方程表示:
k=Ae Ea/RT
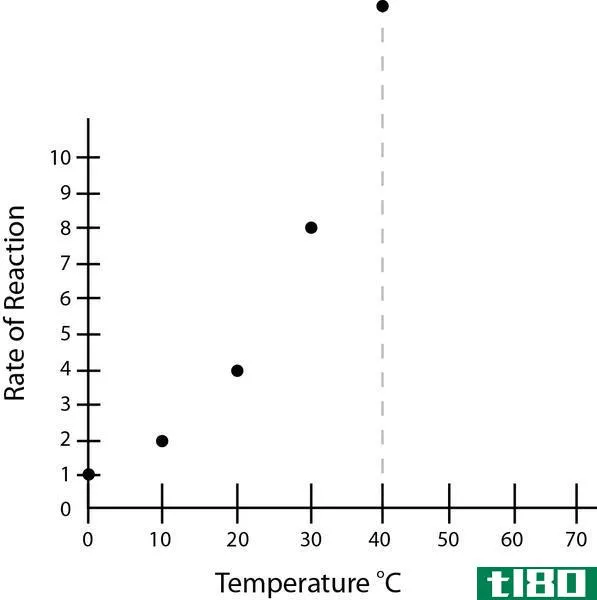
这里,A是粒子碰撞频率的常数,Ea是反应的活化能,R是普遍气体常数,T是绝对温度。从阿累尼乌斯方程可以看出,温度是影响化学反应速率的主要因素。理想情况下,速率常数可以解释影响反应速率的所有变量。
速率常数单位
速率常数的单位取决于反应的顺序。通常,对于a+b级反应,速率常数的单位为mol1−(m+n)·L(m+n)−1·s−1.
- 对于零级反应,速率常数的单位为摩尔/秒(M/s)或摩尔/升/秒(mol·L−1·s−1)
- 对于一级反应,速率常数的单位为每秒s-1
- 对于二级反应,速率常数的单位为升/摩尔/秒(L·摩尔−1·s−1) 或(M)−1·s−1)
- 对于三级反应,速率常数的单位为升平方/摩尔平方/秒(L2·mol−2·s−1) 或(M)−2·s−1)
其他计算和模拟
对于高阶反应或动态化学反应,化学家使用计算机软件进行各种分子动力学模拟。这些方法包括分鞍理论、Bennett-Chandler程序和Milestoning。
不是真常数
尽管它的名字叫速率常数,但它实际上并不是一个常数。它只有在恒定的温度下才成立。它受添加或更换催化剂、改变压力、甚至搅拌化学品的影响。除了反应物的浓度外,如果反应中有任何变化,则不适用。此外,如果一个反应中含有高浓度的大分子,它也不能很好地工作,因为阿累尼乌斯方程假设反应物是进行理想碰撞的完美球体。
来源
- 康纳斯,肯尼斯(1990)。化学动力学:溶液中反应速率的研究。约翰·威利父子公司。ISBN 978-0-471-72020-1。
- 达鲁,查诺斯;斯特林,安德拉斯(2014年)。“分离鞍理论:计算速率常数的新思路”。J.化学。理论计算机。10 (3): 1121–1127. 内政部:10.1021/ct400970y
- 艾萨克斯,尼尔S.(1995)。“第2.8.3节”。物理有机化学(第二版)。哈洛:艾迪生·韦斯利·朗曼。ISBN 9780582218635。
- IUPAC(1997),(化学术语汇编第二版)(黄金书)。
- 莱德勒,K.J.,迈瑟,J.H.(1982)。物理化学。本杰明/卡明斯。ISBN 0-8053-5682-7。
- 发表于 2021-09-17 15:01
- 阅读 ( 473 )
- 分类:法律
你可能感兴趣的文章
通用气体常数(universal gas constant)和特征气体常数(characteristic gas constant)的区别
关键区别-通用气体常数与特征气体常数 气相是物质可以存在的三种主要相之一。它是物质三种状态中最可压缩的状态。在正常情况下,其他元素中只有11种元素以气体的形式存在。然而,“理想气体定律”给了我们一个可以...
- 发布于 2020-09-22 22:50
- 阅读 ( 575 )
利率法(rate law)和群众行动定律(law of mass action)的区别
...式中它们的化学计量系数)。 目录 1. 概述和主要区别 2. 什么是利率定律 3. 什么是质量作用定律 4. 并列比较-速率定律与质量作用定律的表格形式 5. 摘要 什么是费率律(rate law)? 速率定律表示化学反应速率与反应物浓度之间的...
- 发布于 2020-10-05 12:19
- 阅读 ( 567 )
平衡常数(equilibrium constant)和形成常数(formation constant)的区别
平衡常数与生成常数的关键区别在于,平衡常数是平衡时产物浓度与反应物浓度之比,而生成常数是由其组分形成配位化合物的平衡常数。 平衡常数有助于解释不同平衡态的行为。形成常数是一种平衡常数,对配位化合物的...
- 发布于 2020-10-15 00:59
- 阅读 ( 218 )
平衡常数(equilibrium constant)和速率常数(rate constant)的区别
平衡常数和速率常数的关键区别在于,平衡常数用反应物和产物的浓度来表示,而速率常数用反应物或产物的浓度来表示。 平衡常数和速率常数都是特定反应的常数。这意味着,在一个恒定的反应中,温度、平衡常数的值和...
- 发布于 2020-10-15 10:42
- 阅读 ( 345 )
速率表达式(rate expression)和费率律(rate law)的区别
...中可以描述的重要化学概念。 目录 1. 概述和主要区别 2. 什么是速率表达式 3. 什么是利率定律 4. 并排比较-表格形式的速率表达式与速率定律 5. 摘要 什么是速率表达式(rate expression)? 速率表达式表示反应物浓度随反应时间的变...
- 发布于 2020-10-15 15:20
- 阅读 ( 466 )
微分速率定律(differential rate law)和综合费率法(integrated rate law)的区别
...为不同参数之间的数学关系。 目录 1. 概述和主要区别 2. 什么是微分率定律 3. 什么是综合费率法 4. 微分速率律与综合速率律的关系 5. 并列比较-差分率法与综合汇率法的表格形式 6. 摘要 什么是微分速率定律(differential rate law)? ...
- 发布于 2020-10-16 09:23
- 阅读 ( 1226 )
反应级数(order of reaction)和分子量(molecularity)的区别
...子参与了反应。 目录 1. 概述和主要区别 2. 反应的顺序是什么 3. 什么是分子量 4. 并列比较-反应顺序与分子量的表格形式 5. 摘要 什么是反应级数(order of reaction)? 一种物质的反应级数是它在速率方程中浓度增加到的指数。为了...
- 发布于 2020-10-19 12:18
- 阅读 ( 622 )
反应速率(reaction rate)和速率常数(rate constant)的区别
反应速率和速率常数之间的关键区别在于,反应速率是反应物转化为产物的速度,而速率常数是指在给定温度下化学反应速率与反应物浓度或浓度乘积的比例系数反应物。 当一个或多个反应物转化为产物时,它们可能经历不...
- 发布于 2020-10-24 12:11
- 阅读 ( 993 )
平衡(equilibrium)和稳态(steady state)的区别
...同化学反应的重要化学概念。 目录 1. 概述和主要区别 2. 什么是平衡 3. 什么是稳态 4. 并列比较-平衡与稳态的表格形式 5. 摘要 什么是平衡(equilibrium)? 有些反应是可逆的,有些反应是不可逆的。在反应中,反应物转化为产物。...
- 发布于 2020-11-04 13:59
- 阅读 ( 1332 )
sn1型(sn1)和sn2反应(sn2 reactions)的区别
主要区别sn1(main difference sn1) vs. sn2反应(sn2 reacti***) SN1和SN2是有机化学中两种不同类型的亲核取代反应。但是SN1代表单分子反应,反应速率可以用,rate=K[R-LG]表示。与SN1不同的是,SN2代表双分子反应,反应速率可以用rate=K'...
- 发布于 2021-06-27 21:36
- 阅读 ( 890 )