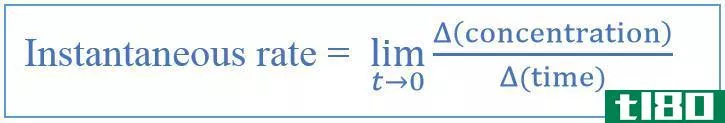反应速率(rate of reaction)和速率常数(rate constant)的区别
主要差异反应速率(main difference rate of reaction) vs. 速率常数(rate c***tant)
化学反应基本上包括产物和反应物。除此之外,还有一些重要的条件需要化学反应进行到完成。这些条件包括适当的温度和压力、离子强度等。然而,每一个化学反应都可以用两个术语来解释:反应速率和速率常数。反应速率描述反应进行的速率,速率常数量化反应速率。反应速率和速率常数之间的主要区别在于,反应速率是反应物浓度的变化或单位时间内产物浓度的变化,而速率常数是与特定反应速率有关的比例常数。
覆盖的关键领域
1.什么是反应速率–定义、性质、示例2.什么是速率常数–定义、性质、示例3.反应速率和速率常数之间的差异是什么–主要差异的比较
Key Terms: Ionic strength, Products, Rate C***tant, Rate of Reaction, Reactants 
什么是反应速率(rate of reaction)?
反应速率或反应速率是单位时间内反应物浓度或产物浓度的变化。这可以通过两种方式获得。一种是将反应过程中消耗的反应物浓度除以消耗的时间。另一种方法是将反应结束时形成的产物的浓度除以形成的时间。这可以缩短如下。
速率=[浓度]/次
但大多数情况下,所有的反应物并不是为反应而消耗的。因此,组分的浓度被视为特定时间段的“浓度变化”。这是由符号给出的Δ. 如果在时间为t1时测量浓度,然后在t2时测量浓度,则反应所用的时间为(t2-t1)=经过的时间(Δt) 是的。因此,时间取为Δt。然后,甚至可以在反应完成之前测量反应速率。
费率=Δ[反应物]/Δ 时间=Δ[产品]/Δ 时间
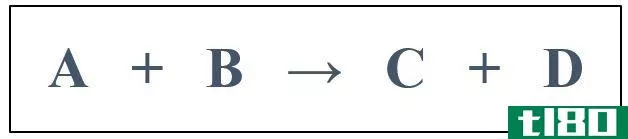
让我们考虑a和B之间的反应,得到产物C。
A+B组合→ C
对于上述反应,可通过测定A、B或C的浓度变化来测量反应速率。
费率=–Δ [A] /Δt型
费率=–Δ [B] /Δt型
费率=Δ[C] /Δt型
注意,在a和B的浓度前面有一个负号。用来表示在反应过程中反应物的减少Δt。但在C的浓度前面没有负号。这是因为碳没有被消耗,而是被产生,所以在整个反应过程中,碳的浓度增加。

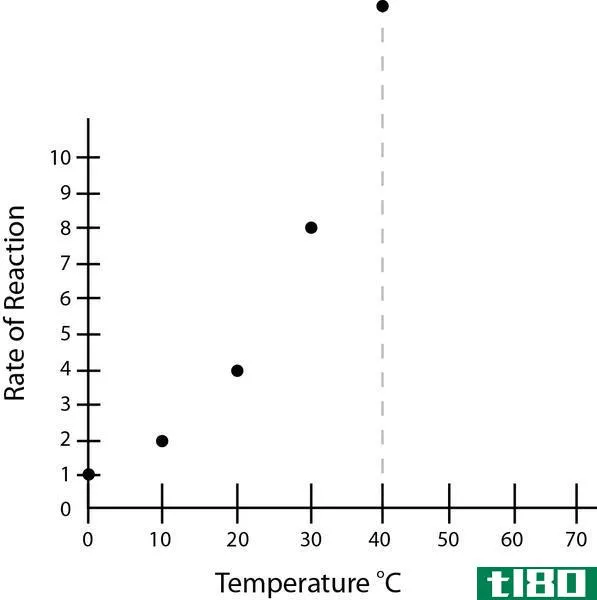
Figure 1: The graph of rate of reaction vs temperature
上图显示了反应速率与酶促反应温度的关系。最佳反应温度是反应速率达到峰值的温度。
什么是速率常数(rate c***tant)?
速率常数是与特定反应速率有关的比例常数。这取决于系统的温度。速率常数给出了反应速率的概念。速率常数的符号是“k”。例如,对于A和B之间的反应,得到了产物C,
费率=–Δ [A] /Δt型
∴ 费率α [[答]
费率=–Δ [B] /Δt型
∴ 费率α [[乙]
上述关系可用于建立反应速率的方程式,如下所示。
速率=k[A]A[B]B
哪里,
k是速率常数。
[A] is the concentration of A [B] is the concentration of Ba是相对于a的反应顺序
b是相对于b的反应级数
对于一个特定的温度,速率常数有一个确定的值,这个值会随着温度的变化而变化。这种温度依赖性由称为“阿伦尼乌斯方程”的方程给出。
K=Ae-(EA/RT)
哪里,
K是速率常数
A是指指数前因子
EA是反应的活化能
R是通用气体常数
T是系统的温度
这个方程表明了温度变化对速率常数的影响以及催化剂的作用。提高温度会增加速率常数。催化剂的加入降低了反应的活化能,提高了反应的速率常数。
反应速率(rate of reaction)和速率常数(rate c***tant)的区别
定义
反应速率:反应速率是单位时间内反应物浓度或产物浓度的变化。
速率常数:速率常数是与特定反应速率有关的比例常数。
摩尔浓度
反应速率:反应速率取决于反应物和产物的摩尔浓度。
速率常数:速率常数不依赖于反应物和产物的摩尔浓度。
温度
反应速率:反应速率间接地取决于温度。
速率常数:速率常数基本上取决于温度。
时间
反应速率:反应速率取决于反应所用的时间。
速率常数:速率常数不依赖于反应所用的时间。
结论
反应速率和速率常数对于确定特定化学反应的最佳条件(如温度)非常重要。这样就很容易处理反应,并能在短时间内得到最佳量的产品。因此,了解反应速率和速率常数的性质及其区别是非常重要的。
引用
1.“速率常数和阿伦尼乌斯方程。”速率常数和阿伦尼乌斯方程。N.p.,2002年10月。网络。这里有。2017年7月14日。 2.“反应速率”百科全书æ大英百科全书。百科全书ædia Britannica,inc.,n.d.网站。这里有。2017年7月14日。 2.“反应速率”百科全书æ大英百科全书。百科全书ædia Britannica,inc.,n.d.网站。
- 发表于 2021-06-29 08:11
- 阅读 ( 577 )
- 分类:科学
你可能感兴趣的文章
初级步骤(elementary step)和速率决定步骤(rate determining step)的区别
... 基本步骤和速率决定步骤的关键区别在于,基本步骤是反应物反应生成最终产品或中间产物的化学反应,而速率决定步骤是多步骤过程中最慢的反应步骤。 在讨论化学反应的反应速率时,特别是在形成最终产物之前有两个或...
- 发布于 2020-09-23 23:37
- 阅读 ( 660 )
利率法(rate law)和群众行动定律(law of mass action)的区别
...率定律和质量作用定律的关键区别在于速率定律表示化学反应速率和反应物浓度之间的关系,而质量作用定律则表示化学反应的速率与反应物质的质量成正比。 速率定律是化学中用来解释反应混合物行为的定律。速率定律表明...
- 发布于 2020-10-05 12:19
- 阅读 ( 558 )
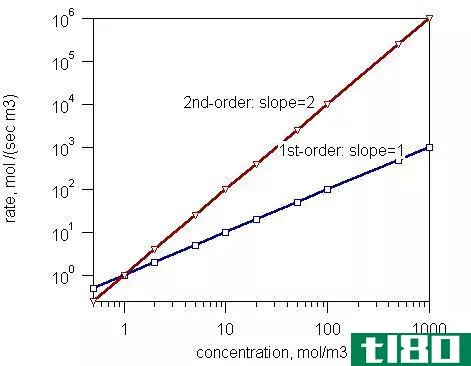
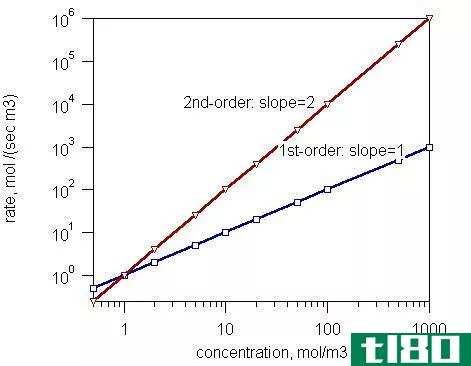
第一(first)和二级反应(second order reactions)的区别
一级反应和二级反应的关键区别在于,一级反应的速率取决于速率方程中反应物浓度的一次方,而二级反应的速率取决于速率方程中浓度项的二次方。 反应级数是速率定律方程中反应物浓度升高到的幂次之和。根据这一定义...
- 发布于 2020-10-13 09:04
- 阅读 ( 1128 )
平衡常数(equilibrium constant)和速率常数(rate constant)的区别
平衡常数和速率常数的关键区别在于,平衡常数用反应物和产物的浓度来表示,而速率常数用反应物或产物的浓度来表示。 平衡常数和速率常数都是特定反应的常数。这意味着,在一个恒定的反应中,温度、平衡常数的值和...
- 发布于 2020-10-15 10:42
- 阅读 ( 338 )
速率表达式(rate expression)和费率律(rate law)的区别
...达式和速率定律的关键区别在于速率表达式给出了产物或反应物出现或消失的速率,而速率定律给出了速率与反应物浓度或压力之间的关系。 当一个或多个反应物转化为产物时,它们可能经历不同的修饰和能量变化。反应物中...
- 发布于 2020-10-15 15:20
- 阅读 ( 457 )
微分速率定律(differential rate law)和综合费率法(integrated rate law)的区别
...速率定律的关键区别在于,微分速率定律给出了一个化学反应速率,它是一个特定时间段内一个或多个反应物浓度变化的函数,而积分速率定律给出的是化学反应速率与初始值的函数关系一段时间后一种或多种反应物的浓度。 ...
- 发布于 2020-10-16 09:23
- 阅读 ( 1219 )
瞬时速率(instantaneous rate)和平均费率(average rate)的区别
关键区别——瞬时速率与平均速率 在化学反应中,反应速率可以用瞬时速率和平均速率两种方法来确定。瞬时速率和平均速率之间的关键区别在于,瞬时速率测量在已知时间段内反应物或产物浓度的变化,而平均速率则测量...
- 发布于 2020-10-19 04:13
- 阅读 ( 401 )
反应级数(order of reaction)和分子量(molecularity)的区别
...顺序与分子量的表格形式 5. 摘要 什么是反应级数(order of reaction)? 一种物质的反应级数是它在速率方程中浓度增加到的指数。为了理解这个概念,我们首先要知道什么是速率定律。 费率律 速率定律表明,化学反应(在恒定温度...
- 发布于 2020-10-19 12:18
- 阅读 ( 613 )
单分子(unimolecular)和双分子反应(bimolecular reactions)的区别
...B] 总的顺序总是2。下面给出了一些双分子反应的例子。 Reaction between CO and NO3 Reaction between two NOCl molecules Reaction between Cl and CH4 单分子(unimolecular)和双分子反应(bimolecular reacti***)的共同点 单分子反应和双分子反应都是基本反应。...
- 发布于 2020-10-19 13:00
- 阅读 ( 606 )
反应速率(reaction rate)和速率常数(rate constant)的区别
...反应速率与速率常数的表格形式 5. 摘要 什么是反应速率(reaction rate)? 反应速率或反应速率是反应物转化为产物的速度。反应速率只是反应速度的指示。因此,我们可以把它看作一个决定反应速度和速度的参数。当然,有些反应...
- 发布于 2020-10-24 12:11
- 阅读 ( 988 )