反应商(reaction quotient)和平衡常数(equilibrium constant)的区别
主差反应商(main difference reaction quotient) vs. 平衡常数(equilibrium c***tant)
在一个系统中发生的所有化学反应都可以被认为是平衡反应或非平衡反应。当反应物没有完全分解成离子时,反应就变成了平衡反应。非平衡反应包括反应物的完全电离。反应商和平衡常数是用来解释体系中发生化学反应的两个术语。反应商给出了反应混合物中存在的化学物质的数量。平衡常数是产物浓度与反应物浓度之比。反应商和平衡常数的主要区别在于,反应商可以在任何时间计算,而平衡常数是在平衡点计算的。
覆盖的关键领域
1.什么是反应商-定义,计算公式,例2.什么是平衡常数-定义,应用,例3.反应商和平衡常数之间的关系是什么?解释的相关性4.反应商和平衡常数之间的区别是什么?关键区别的比较
Key Terms: Equilibrium, Equilibrium C***tant, Ionization, Reactants, Reaction Quotient, Stoichiometry
什么是反应商(reaction quotient)?
反应商是产物浓度与反应物浓度之比。这在数学上可以缩写如下。让我们考虑下面的反应。
N2(g)+3H2(g)↔ 2NH3(克)
该反应的反应商可如下所示。写反应商时,还应考虑组分的化学计量比。在这里,化学计量系数表示的比例组成也被考虑。浓度增加到该系数的幂次方。
上述反应的反应商为,
反应商(Qc)=[NH3(g)]2/[N2(g)][H2(g)]3
反应商可以在反应的任何时候计算出来。这意味着,当一个反应达到平衡之前,当平衡发生变化或反应处于平衡状态时,可以计算出系统的反应商。
也可以用各组分的“活度”来计算反应商,而不是各组分的浓度。物质的活性描述了该物质的化学势。

什么是平衡常数(equilibrium c***tant)?
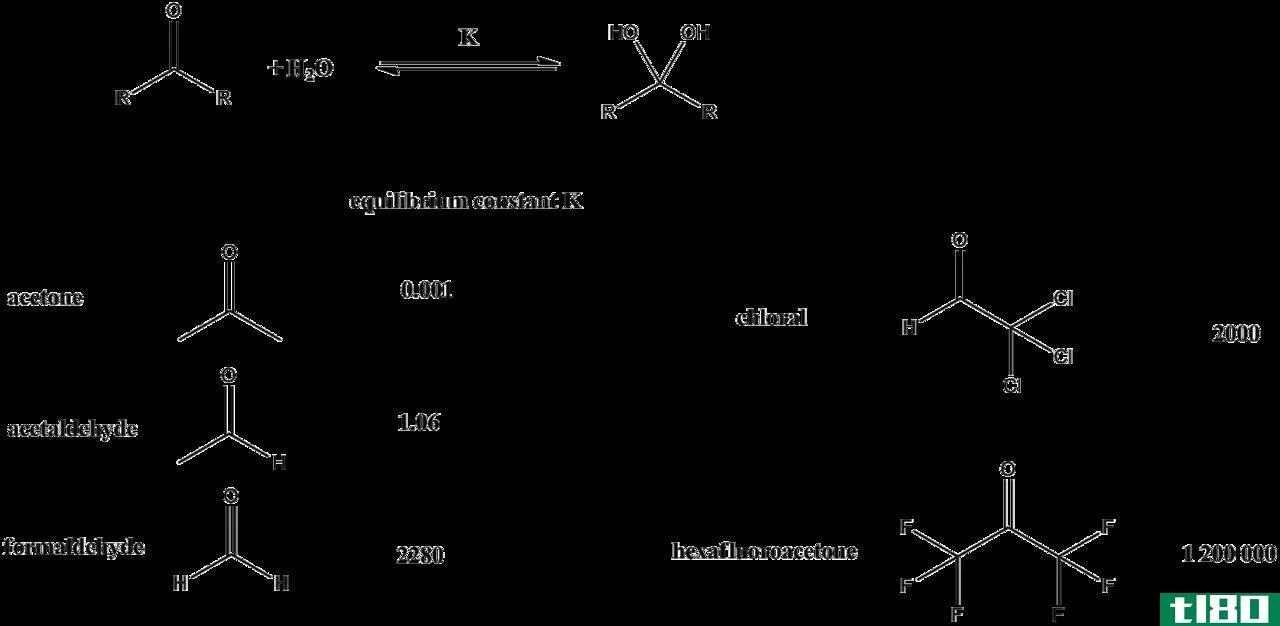
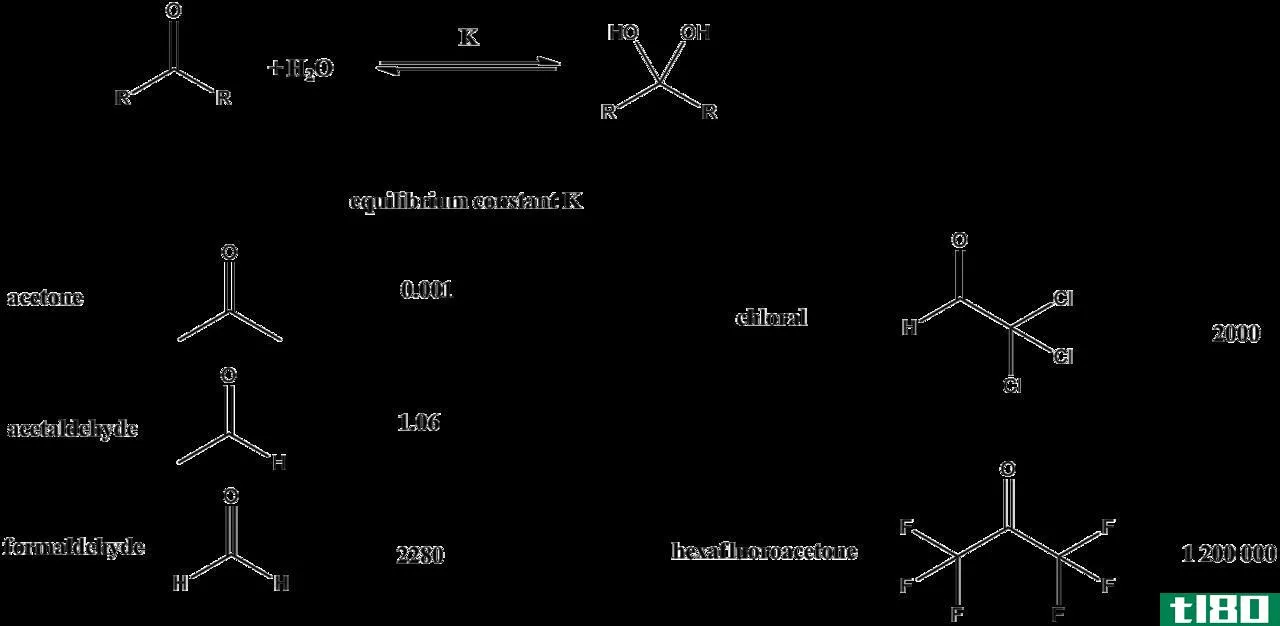
平衡常数是平衡时产物浓度与反应物浓度之比。这个术语只用于处于平衡状态的反应。对于处于平衡状态的反应,反应商和平衡常数是相同的。
平衡常数也表示为浓度增加到化学计量系数的幂次方。平衡常数取决于所考虑系统的温度,因为温度影响组分的溶解度和体积膨胀。然而,平衡常数的方程式不包括反应物或产物中固体的任何细节。只考虑液相和气相物质。
例如,让我们考虑碳酸和碳酸氢根离子之间的平衡。
硫酸(aq)↔ HCO3–(aq)+H+(aq)
上述反应的平衡常数如下所示。
平衡常数(K)=[HCO3–(aq)][H+(aq)]/[H2CO3(aq)]
反应商与平衡常数的关系
- 如果反应商(Q)大于平衡常数(K),由于体系中产物的量大于反应物的量,反应对反应物更有利。然后反应倾向于形成更多的反应物以保持平衡。
- 当Q小于K时,反应物比产物多。因此,反应倾向于形成更多的产物以保持平衡。
- 如果Q和K相等,则反应混合物处于平衡状态。
反应商(reaction quotient)和平衡常数(equilibrium c***tant)的区别
定义
反应商:反应商是产物浓度与反应物浓度的比值。
平衡常数:平衡常数是平衡时产物浓度与反应物浓度之比。
应用
反应商:反应商可用于反应中的任何一点(在达到平衡之前或之后)。
平衡常数:平衡常数只能用于反应处于平衡状态的点。
方向详情
反应商:反应商给出了反应进行的方向。
平衡常数:平衡常数没有给出反应进行方向的任何细节。
价值
反应商:在反应进行过程中,反应商的值是不同的。
平衡常数:在特定的温度下,对于特定的平衡,平衡常数的值是恒定的。
结论
虽然反应商和平衡常数看起来是一样的,但它们之间有明显的差别。这是因为反应商包括反应中任何一点的组分浓度,而平衡常数包括平衡点上各组分的浓度。因此,对这些反应的每一项使用正确的细节是非常重要的。
引用
- 发表于 2021-06-29 08:09
- 阅读 ( 880 )
- 分类:科学
你可能感兴趣的文章
平衡常数(equilibrium constant)和形成常数(formation constant)的区别
...平衡常数与表格形式的形成常数 5. 摘要 什么是平衡常数(equilibrium c***tant)? 平衡常数是平衡时产物浓度与反应物浓度之比。这个术语只用于平衡的反应。对于处于平衡状态的反应,反应商和平衡常数是相同的。 平衡常数也作为...
- 发布于 2020-10-15 00:59
- 阅读 ( 214 )
摩尔溶解度(molar solubility)和产品溶解度常数(product solubility constant)的区别
摩尔溶解度和产品溶解度常数之间的关键区别在于摩尔溶解度描述了每升溶液中物质的溶解,而产品溶解度常数描述了固体物质在水溶液中的溶解。 摩尔溶解度和产物溶解度常数都是描述物质在溶液中溶解的化学概念。我们...
- 发布于 2020-10-15 10:26
- 阅读 ( 1095 )
平衡常数(equilibrium constant)和速率常数(rate constant)的区别
...平衡常数与速率常数的表格形式 5. 摘要 什么是平衡常数(equilibrium c***tant)? 平衡常数是平衡时产物浓度与反应物浓度之比。我们只能用在平衡的反应上。对于处于平衡状态的反应,反应商和平衡常数是相同的。 此外,我们必须...
- 发布于 2020-10-15 10:42
- 阅读 ( 338 )
同种类的(homogeneous)和非均相平衡(heterogeneous equilibrium)的区别
...均质平衡与非均质平衡 5. 摘要 什么是均相平衡(homogeneous equilibrium)? 均相平衡是指反应物和产物处于物质同一相的状态。通常,反应物和产物在一个溶液中。我们称这种反应混合物为均相混合物。这种混合物中的化学物质可以...
- 发布于 2020-10-15 11:11
- 阅读 ( 617 )
化学平衡(chemical equilibrium)和动态平衡(dynamic equilibrium)的区别
...衡与动态平衡的表格形式 6. 摘要 什么是化学平衡(chemical equilibrium)? 化学平衡是指反应物和产物的浓度都不随时间变化的状态。有些反应是可逆的,有些反应是不可逆的。在反应中,反应物转化为产物。在某些反应中,反应物...
- 发布于 2020-10-16 10:55
- 阅读 ( 544 )
平衡常数(equilibrium constant)和平衡位置(equilibrium position)的区别
...衡常数与平衡位置的表格形式 5. 摘要 什么是平衡常数(equilibrium c***tant)? 平衡常数是给出反应混合物在其平衡状态下的产物量和反应物数量之间关系的数字。反应混合物的平衡状态是指反应物或产物不再发生变化的系统所接近...
- 发布于 2020-10-19 02:44
- 阅读 ( 560 )
酸电离常数(acid ionization constant)和碱基电离常数(base ionization constant)的区别
关键区别-酸电离常数与碱电离常数 酸离子化常数(Ka,也称为酸离解常数)定量测量了酸分子与其电离形式之间的平衡。同样,碱离解常数(Kb,或碱离解常数)可定量测量碱分子与其电离形式之间的平衡。酸电离常数和碱...
- 发布于 2020-10-19 03:06
- 阅读 ( 425 )
身体的(physical)和化学平衡(chemical equilibrium)的区别
...理和化学平衡的表格形式 6. 摘要 什么是物理平衡(physical equilibrium)? 物理平衡是指系统的物理状态不变的平衡状态。物质从一个相到另一个相的转变是一个物理过程。因此,物理状态不随时间变化的平衡状态称为物理平衡。物...
- 发布于 2020-10-19 07:30
- 阅读 ( 380 )
逐步(stepwise)和总稳定常数(overall stability constants)的区别
关键区别-逐步与整体稳定常数 稳定常数是指溶液中形成复杂化合物的平衡常数。这是一种测量这些过渡金属离子配合物稳定性的方法。与其他平衡常数一样,稳定常数也与温度有关。稳定常数的定义为“过渡金属离子与某些...
- 发布于 2020-10-19 14:00
- 阅读 ( 491 )
kd公司(kd)和公里(km)的区别
...物(P)的形成如下: E+S公司↔ E-S复合体↔ E+P公司 If the equilibrium c***tants of above reaction are as follows, you can derive Km from these c***tants. 公里=K-1+K+2/K+1 基于迈克尔概念的km确定 Michaelis利用底物浓度[S]和最大反应速度Vmax建立了一个关...
- 发布于 2020-10-22 19:32
- 阅读 ( 321 )