西格玛(sigma)和pi键(pi bond)的区别
什么是西格玛键(sigma bond)?
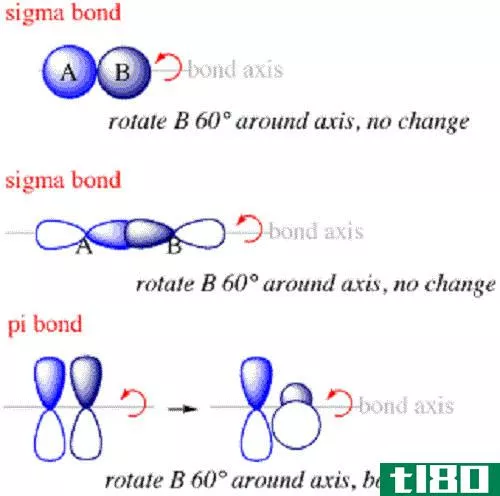
Sigma键是分子中原子之间的键,沿着连接原子束缚核的轴形成。
分子键
当原子通过化学键交换或共享电子时,分子就形成了。基本上有三种债券。离子键、金属键和共价键。在离子键中,原子只需交换一个电子,使一个原子带正电,另一个带负电,使它们被电磁力吸引。在金属键中,电子将均匀分布在整个分子中,形成一个自由的、非定域的电子海洋,包围着被电子吸引的带正电离子。
在共价键中,电子是共享的,共享的方式是通过电子的概率云,以及它们所在的轨道,以一种大致对称的方式重叠。
轨道和sigma键
轨道是原子周围与某些能级有关的区域。离原子核较远的轨道上的电子比离原子核较近的轨道上的电子具有更多的能量。当一个原子的轨道与另一个原子的轨道重叠时,它们形成分子轨道,允许分子键,当然,允许分子键。
西格玛键是原子间形成的第一种键。在sigma键中,电子概率云将沿着连接键合原子核的轴。当来自不同原子的s轨道重叠形成键时,通常会形成Sigma键。它们总是沿着两个原子核之间的轴形成,因为s轨道围绕着原子核呈球形排列。
sigma键和sigma轨道
组成sigma键的电子将在sigma轨道内,因此将位于连接键合原子核的轴的某处。然而,sigma键可以是稳定的,也可以是不稳定的,这取决于电子是在sigma键轨道上还是在反键轨道上。
Sigma成键轨道位于原子核之间的空间,而反成键轨道位于连接原子核的轴上,但位于原子与原子核之间空间相对的一侧。如果更多的电子在成键轨道上,sigma键将是稳定的;如果更多的电子在反成键轨道上,或者如果两个轨道上的电子数量相等,sigma键将是不稳定的。
什么是pi键(pi bond)?
π键是分子中原子间的键,其中电子位于连接原子核的轴的上方和下方,但不沿轴。它们是继sigma键之后在分子中形成的第二种键。
π键和p轨道
π键形成于键轴上下,而不是沿着键轴,这是因为它们通常是由键合原子上的p轨道等重叠轨道形成的。这些轨道在原子核上没有电子密度。因此,由重叠的p轨道形成的π键所组成的电子总是**在与原子核不直接相邻的区域。π键也可以在其他原子轨道之间形成,例如d轨道,它与p轨道有共同的特征。
π键和π轨道
当不同原子的p轨道重叠时,它们产生分子π轨道,从而形成π键。根据电子所处的轨道,键可以是稳定的,也可以是不稳定的。如果π键轨道上有更多的电子,π键将是稳定的。如果反键轨道上有更多的原子,或者两个轨道上的原子数相等的话,这将是不稳定的。
sigma键和pi键的相似性
Sigma键和pi键都基于特定的分子轨道,这些轨道是由特定的原子轨道重叠而来的,例如Sigma键的s轨道和pi键的p轨道。它们也可以是稳定的或不稳定的,这取决于电子是在成键分子轨道上还是在反键分子轨道上。
sigma键和pi键的区别
尽管它们有相似之处,但也有重要区别。
- 组成sigma键的电子将沿连接核的轴分布在空间中,而π键中的电子将分布在轴的上下,但不沿轴分布。
- Sigma键是分子中原子间形成的第一个键,而pi键是第二个键。
- Sigma键通常由不同原子的s轨道组合而成,而pi键则由p轨道和不同原子的相似轨道组合而成。
- 此外,形成π键的重叠轨道的方向将垂直于形成sigma键的重叠轨道的方向。
西格玛键与π键
| 西格玛键 | Pi键 |
| 原子轨道沿键轴重叠 | 原子轨道在键轴上下重叠 |
| 分子中原子间形成的第一个键 | 分子中原子间形成的第二个键 |
| 由重叠轨道形成的,如s轨道 | 由重叠轨道形成的,如p轨道 |
| 垂直于π键的重叠轨道 | 垂直于sigma键的重叠轨道 |
总结 - :西格玛(: sigma) vs. pi债券(pi bonds)
sigma键是分子中原子间的键,通常由s轨道沿连接原子核的轴重叠而成。它是第一个形成的,它的稳定性取决于电子在sigma键和反键轨道中的分布。π键是由不同原子的p轨道重叠形成的分子键。构成π键的电子将分布在连接键合原子核的轴的上方和下方,但不沿轴分布。这些键的稳定性还取决于成键和反键π轨道。西格玛键将是分子内形成的第一个键,而π键将是第二个形成的键。π键也由垂直于sigma键的原子轨道形成。
- 发表于 2021-06-25 03:25
- 阅读 ( 720 )
- 分类:化学
你可能感兴趣的文章
回粘超共轭(backbonding hyperconjugation)和共轭(conjugation)的区别
...共轭是指σ键与π网络的相互作用。在这种相互作用中,西格玛键中的电子与相邻的部分(或完全)填充的p轨道或π轨道相互作用。这种相互作用是为了提高分子的稳定性。 图02:超共轭 一般来说,超共轭是由于C-Hσ键中的键电...
- 发布于 2020-09-20 20:03
- 阅读 ( 402 )
外环(exocyclic)和内循环双键(endocyclic double bond)的区别
...键(an exocyclic double bond)? 外循环双键是由两个碳原子通过西格玛键和π键相互结合的共价化学键。这种双键是环结构中两个碳原子之一。我们只能在不饱和有机化合物中观察到外环双键(不饱和化合物是具有双键或三键的化学化...
- 发布于 2020-09-30 00:05
- 阅读 ( 315 )
超共轭(hyperconjugation)和诱导效应(inductive effect)的区别
...轭是σ-键与π键网络的相互作用。在这个概念中,我们说西格玛键中的电子与相邻的部分(或完全)填充的p轨道或π轨道发生相互作用。这个过程是为了增加分子的稳定性。 图01:超共轭过程的一个例子 超共轭的原因是C-Hσ键中...
- 发布于 2020-10-16 03:18
- 阅读 ( 477 )
本地化的(localised)和离域化学键(delocalised chemical bonds)的区别
定域化学键和离域化学键的关键区别在于,定域化学键是特定原子上的特定键或孤电子对,而离域化学键是与单个原子或共价键无关的特定键。 化学键是两个原子之间的连接。这种联系是由于分子轨道的重叠造成的。化学键...
- 发布于 2020-10-18 06:56
- 阅读 ( 312 )
乙烷乙烯(ethane ethene)和乙炔(ethyne)的区别
...式为C2H6。它是第二简单的烷烃。烷烃是一种原子间只有西格玛键的有机化合物。因此,乙烷的化学结构只有单键,因此,它是一种饱和化合物。 乙烷化学结构图1 乙烷分子的碳原子是sp3杂化碳原子。这意味着分子中的每个碳原...
- 发布于 2020-10-18 19:07
- 阅读 ( 1157 )
饱和的(saturated)和不饱和键(unsaturated bonds)的区别
饱和键和不饱和键的关键区别在于饱和键没有π键,而非饱和键总是有π键。 化学键是原子间的键。这些键导致分子的形成。有两种主要的键,它们是共价键和离子键。然而,金属中的键是金属键。两个原子共用价电子时形成...
- 发布于 2020-10-21 08:38
- 阅读 ( 243 )
双键(double bond)和单一债券(single bond)的区别
双键和单键的关键区别在于,在单键形成中,两个原子只共享一个电子对,而在双键形成中,两个原子共享两个电子对。 正如美国化学家G.N.Lewis提出的那样,当原子的价壳层中含有8个电子时,原子是稳定的。大多数原子的价...
- 发布于 2020-10-26 19:01
- 阅读 ( 382 )
阿尔法-卡帕-阿尔法(alpha kappa alpha)和δ-西格玛θ(delta sigma theta)的区别
α-卡帕α与δ-西格玛θ 许多大学生热衷于参加学校的活动,投身于成为组织的一部分。有两种类型的组织:学术组织和课外组织。学术组织可以是辩论队、数学和科学俱乐部。然而,课外组织与学术无关。他们主要关注自我发...
- 发布于 2021-06-23 15:41
- 阅读 ( 285 )
西格玛(sigma)和pi键(pi bond)的区别
什么是西格玛键(sigma bond)? Sigma键是分子中原子之间的键,沿着连接原子束缚核的轴形成。 分子键 当原子通过化学键交换或共享电子时,分子就形成了。基本上有三种债券。离子键、金属键和共价键。在离子键中,原子只需交...
- 发布于 2021-06-25 03:25
- 阅读 ( 720 )
键对(bond pair)和孤独的一对(lone pair)的区别
...子对。电子对有键对和孤对两种类型。键对和孤对的主要区别是键对由两个键中的电子组成,而孤对由两个不在键中的电子组成。 覆盖的关键领域 1.什么是键对-定义、识别、示例2.什么是孤对-定义、识别、示例3.键对和孤对的...
- 发布于 2021-06-29 09:14
- 阅读 ( 628 )