共价键(covalent bonds)和离子键(ionic bonds)的区别
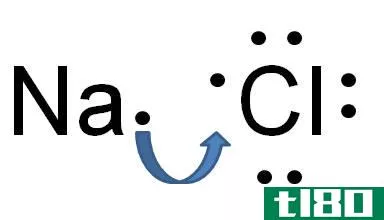
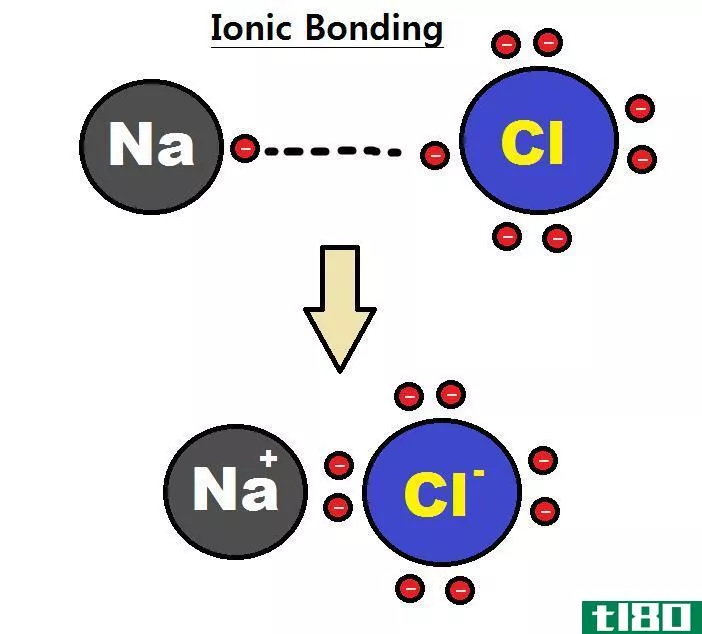
原子键有两种类型-离子键和共价键。它们的结构和性质不同。共价键由两个原子共享的一对电子组成,并以固定的方向与原子结合。打破它们需要相对较高的能量(50-200千卡/摩尔)。两个原子能否形成共价键取决于它们的电负性,即分子中原子吸引电子的能力。如果两个原子的电负性有很大的不同,就像钠和氯一样,那么其中一个原子的电子会被另一个原子失去。这会产生带正电荷的离子(阳离子)和带负电荷的离子(阴离子)。这两个离子之间的键称为离子键。
对比图
共价键与离子键对比图| 共价键 | 离子键 | |
|---|---|---|
| 极性 | 低 | 高 |
| 形成 | 两种电负性相似的非金属之间形成共价键。两个原子的“强度”都不足以吸引另一个原子的电子。为了稳定,他们与其他人共享来自外分子轨道的电子。 | 金属和非金属之间形成离子键。非金属(-ve公司离子)比金属(+ve公司离子)强,很容易从金属中获得电子。这两个相反的离子相互吸引,形成离子键。 |
| 形状 | 确定形状 | 没有确定的形状 |
| 什么是它(it)? | 共价键是两个非金属原子之间的化学键的一种形式,其特征是原子和其他共价键之间共享一对电子。 | 离子键,也称为电价键,是由化合物中带相反电荷的离子之间的静电吸引形成的一种键。这类键主要发生在金属原子和非金属原子之间。 |
| 熔点 | 低的 | 高 |
| 示例 | 甲烷(甲烷)氢氯酸(盐酸) | 氯化钠(氯化钠)硫酸(硫酸) |
| 发生在 | 两种非金属 | 一种金属和一种非金属 |
| 沸点 | 低 | 高 |
| 室温状态 | 液体或气体 | 固体 |
关于共价键和离子键
共价键是在两个原子能够共享电子时形成的,而离子键是在“共享”不相等时形成的,即原子A中的一个电子完全丢失给原子B,从而产生一对离子。
每个原子由质子、中子和电子组成。在原子的中心,中子和质子保持在一起。但是电子在轨道上围绕中心旋转。每一个分子轨道都可以有一定数量的电子形成一个稳定的原子。但除了惰性气体,大多数原子都不存在这种构型。为了稳定原子,每个原子共享一半的电子。
共价键是两个非金属原子之间的化学键的一种形式,其特征是原子和其他共价键之间共享一对电子。离子键,也称为电价键,是由化合物中带相反电荷的离子之间的静电吸引形成的一种键。这种键主要发生在金属原子和非金属原子之间。
形成和示例
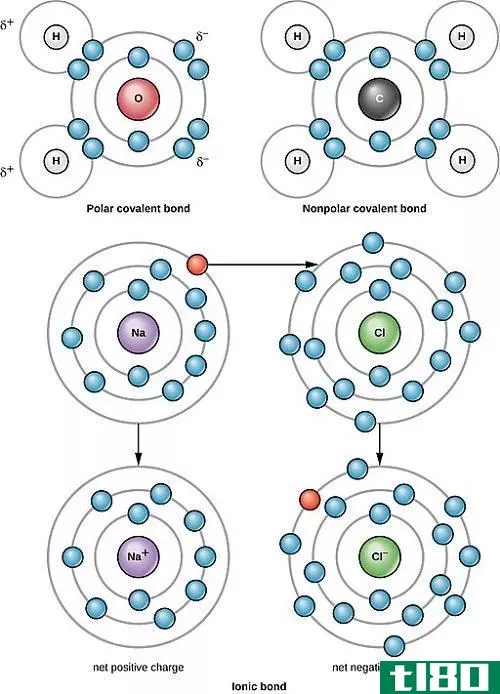
共价键是由于一对或多对键合电子的共享而形成的。两个键合原子的电负性(电子吸引能力)要么相等,要么相差不大于1.7。只要电负性差不大于1.7,原子就只能共享成键电子。

例如,让我们考虑甲烷分子,即CH4。碳具有6个电子,其电子构型为1S22S22P2,即它的外轨道中有4个电子。根据八态定律(它指出原子倾向于获得、失去或共享电子,因此每个原子都有完整的最外层能级,通常是8个电子),要处于稳定状态,它还需要4个电子。因此它与氢形成共价键(1s1),通过与氢共享电子,它形成甲烷或CH4。
如果电负性差大于1.7,则较高的电负性原子具有足够大的电子吸引能力,以迫使电子从较小的电负性原子转移。这导致离子键的形成。

例如,在普通食盐(NaCl)中,单个原子是钠和氯。氯在外轨道上有七个价电子,但要保持稳定,它需要在外轨道上有八个电子。另一方面,钠有一个价电子,它也需要八个电子。由于氯的电负性很高,与钠的0.9相比为3.16(因此它们的电负性之差大于1.7),氯很容易吸引钠的一价电子。通过这种方式,它们形成了一个离子键,并共享彼此的电子,而且它们的外壳中都有8个电子。
示例
债券的特征
共价键有一个明确的和可预测的形状和低熔点和沸点。当原子靠近以共享电子时,它们很容易被分解成一级结构。它们大多是气态的,甚至在共价键的两端稍有负电荷或正电荷,就形成了分子极性。
离子键通常形成晶体化合物,与共价化合物相比具有更高的熔点和沸点。它们在熔融或溶解状态下导电,是极性键。它们大多溶于水,不溶于非极性溶剂。它们需要比共价键更多的能量来破坏它们之间的键。
离子键和共价键的熔点和沸点不同的原因可以通过NaCl(离子键)和Cl2(共价键)的例子来说明。这个例子可以在Cartage.org上找到。
参考文献
- 维基百科:双键
- Covalent Bonds -纽约城市大学
- 化学键-乔治亚州立大学
- 共价键和离子键-访问卓越
- 电子共价键与共价键——牛津大学
- 维基百科:分子轨道图
- 维基百科:电子构型
- 离子键-大英百科全书
- 发表于 2021-07-04 07:24
- 阅读 ( 412 )
- 分类:科学
你可能感兴趣的文章
共价键(covalent bond)和与格键(dative bond)的区别
共价键和与格键的关键区别在于,当两个原子的未成对电子相互结合时,共价键就形成了;而与格键则是当一个原子将它的一对电子捐赠给另一个原子时形成的。 虽然与格键看起来像共价键,但当我们考虑键的形成时,它们...
- 发布于 2020-10-17 17:57
- 阅读 ( 843 )
电价的(electrovalent)和共价键(covalent bond)的区别
电子价键和共价键的关键区别在于,电子价键是通过将电子从一个原子转移到另一个原子而产生的,而共价键则是原子间共享价电子的结果。离子键也叫价键。价电子是位于原子最外层的电子,参与两种化学键合。 化学键合...
- 发布于 2020-10-23 11:30
- 阅读 ( 343 )
共价(covalent)和非共价债券(noncovalent bonds)的区别
共价键和非共价键的关键区别在于,当两个原子共享它们的电子时,共价键就形成了,而非共价键则是通过两个原子之间完全交换电子或不交换任何电子而形成的。 化学键主要有四种类型:共价键、离子键、氢键和范德华相...
- 发布于 2020-10-23 12:39
- 阅读 ( 458 )
离子键合(ionic bonding)和金属键合(metallic bonding)的区别
...都可以实现稀有气体的电子组态。这是通过形成离子键、共价键或金属键来实现的。 目录 1. 概述和主要区别 2. 什么是离子键 3. 什么是金属键合 4. 并列比较-离子键与金属键的表格形式 5. 摘要 什么是离子键合(ionic bonding)? 原子...
- 发布于 2020-10-24 01:03
- 阅读 ( 852 )
离子型(ionic)和共价化合物(covalent compounds)的区别
...认为是离子化合物和共价化合物的关键区别。(离子键和共价键的区别)当离子键形成时,电子由金属捐赠,捐赠电子被非金属接受。由于静电的吸引,它们形成了一个牢固的键。两种非金属之间形成共价键。在共价键合中,两...
- 发布于 2020-10-24 16:55
- 阅读 ( 489 )
离子型(ionic)和共价键(covalent bonds)的区别
离子键和共价键之间的关键区别在于,离子键发生在电负性非常不同的原子之间,而共价键发生在电负性差异相似或极低的原子之间。 正如美国化学家G.N.Lewis提出的那样,当原子的价壳层中含有8个电子时,原子是稳定的。...
- 发布于 2020-11-05 20:46
- 阅读 ( 464 )
非极性(non-polar)和极性共价键(polar covalent bonds)的区别
非极性与极性共价键 非极性和极性共价键既属于极性的三类,也属于共价键的两类。所有这三种类型(离子、极性和非极性)都被归类为化学键,其中有一种力(电负性)允许两种特定元素的原子相互吸引。可能的共价键的数...
- 发布于 2021-06-24 05:05
- 阅读 ( 606 )
离子型(ionic)和共价化合物(covalent compounds)的区别
...名思义,离子化合物是由离子键构成的,共价化合物是由共价键构成的。离子键发生在相互静电吸引的两个物种之间,而共价原子通过它们外壳之间的电子共享而共价键合。这是离子化合物和共价化合物的主要区别。一般来说,...
- 发布于 2021-06-27 07:49
- 阅读 ( 479 )
离子型(ionic)和分子化合物(molecular compounds)的区别
...它们彼此不同。离子化合物由离子键构成,分子化合物由共价键构成。离子键发生在两个相互静电吸引的物种之间,而共价键则是通过它们外壳之间的电子共享而形成的。这是离子化合物和分子化合物的主要区别。一般来说,金...
- 发布于 2021-06-27 10:56
- 阅读 ( 437 )
离子共价(ionic covalent)和金属键(metallic bonds)的区别
...分子结合在一起的力。主要有三种类型的键,即离子键、共价键和金属键。二次键包括色散键、偶极键和氢键。一次键具有较高的键能,与二次力相比,它更稳定。离子共价键与金属键的主要区别在于它们的形成;当一个原子向...
- 发布于 2021-06-28 11:41
- 阅读 ( 809 )