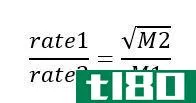gay-lussac气体定律示例
盖伊·卢萨克气体定律是理想气体定律的一个特例,其中气体的体积保持不变。当体积保持恒定时,气体施加的压力与气体的绝对温度成正比。简单来说,假设体积不变,提高气体温度会增加其压力,而降低温度会降低压力。这个定律也被称为盖伊·卢萨克的压力-温度定律。盖伊·卢萨克在1800年至1802年间制定了这项法律,当时他正在制作一个空气温度计。这些示例问题使用Gay Lussac定律来计算加热容器中的气体压力以及改变容器中气体压力所需的温度。

主要收获:盖伊·卢萨克定律的化学问题
- 盖伊·卢萨克定律是理想气体定律的一种形式,其中气体体积保持不变。
- 当体积保持不变时,气体的压力与其温度成正比。
- Gay-Lussac定律的常用方程为P/T=常数或Pi/Ti=Pf/Tf。
- 该定律起作用的原因是,温度是平均动能的量度,因此,随着动能的增加,会发生更多的粒子碰撞,压力也会增加。如果温度降低,动能减少,碰撞减少,压力降低。
盖伊·卢萨克的法律例子
一个20升的钢瓶在27℃时含有6个大气压(atm)的气体。如果气体被加热到77摄氏度,气体的压力会是多少?
要解决此问题,只需执行以下步骤:当气体被加热时,钢瓶的体积保持不变,因此Gay Lussac的气体定律适用。Gay-Lussac的气体定律可以表示为:Pi/Ti=Pf/Tf,其中Pi和Ti是初始压力和绝对温度Ff和Tf是最终压力和绝对温度First,将温度转换为绝对温度。Ti=27 C=27+273 K=300 KTf=77 C=77+273 K=350 KUse在盖伊·卢萨克方程中计算这些值并求解Pf。Pf=PiTf/TiPf=(6 atm)(350K)/(300 K)Pf=7 atm得出的答案是:将气体从27 C加热到77 C后,压力将增加到7 atm。
另一个例子
通过解决另一个问题,看看你是否理解了这个概念:找到将10.0升25摄氏度时压力为97.0千帕的气体的压力改变为标准压力所需的温度(摄氏度)。标准压力为101.325 kPa。
首先,将25摄氏度转换为开尔文(298K)。请记住,开尔文温标是一个绝对温标,其定义是:恒定(低)压力下的气体体积与温度成正比,水的冰点和沸点之间的距离为100度。
将数字插入方程式,以获得:
97.0 kPa/298 K=101.325 kPa/x
求解x:
x=(101.325千帕)(298千帕)/(97.0千帕)
x=311.3K
减去273得到以摄氏度为单位的答案。
x=38.3摄氏度
提示和警告
在解决同性恋卢萨克的法律问题时,请记住以下几点:
- 气体的体积和数量保持不变。
- 如果气体温度升高,压力升高。
- 如果温度降低,压力降低。
温度是气体分子动能的量度。在低温下,分子移动更慢,并会频繁撞击无容器容器的壁。随着温度的升高,分子的运动也随之增加。它们更频繁地撞击容器壁,这被视为压力增加。
直接关系仅适用于温度以开尔文表示的情况。学生在处理这类问题时最常见的错误是忘记转换为开尔文,或者转换不正确。另一个错误是忽略了答案中的重要数字。使用问题中给出的最小有效数字。
来源
- 巴内特,马丁K(1941). "测温法简史”。化学教育杂志,18(8):358。内政部:10.1021/ed018p358
- 卡斯特卡,约瑟夫F。;梅特卡夫,H。克拉克;戴维斯,雷蒙德E。;威廉姆斯,约翰E(2002). 现代化学。霍尔特、林哈特和温斯顿。ISBN 978-0-03-056537-3。
- 克罗斯兰,M。P(1961年,“盖伊·卢萨克气体体积合并定律的起源”,《科学年鉴》,17(1):1,内政部:10.1080/000337961002521
- 盖伊·卢萨克,J。L(1809). "《物质组合》杂志《气体物质相互组合回忆录》。阿尔丘伊社会博物馆2:207–234。
- 蒂彭斯,保罗E(2007). 物理学,第七版,麦格劳·希尔。386–387.
- 发表于 2021-09-06 23:15
- 阅读 ( 296 )
- 分类:化学
你可能感兴趣的文章
格雷厄姆渗出定律(graham’s law of effusion)和扩散(diffusion)的区别
...之间的关键区别在于,格雷厄姆的渗出定律适用于通过比气体颗粒小的开口的气体,而格雷厄姆扩散定律适用于在容器中分散的气体分子。 格雷厄姆定律指出,气体的扩散或渗出速率与其摩尔质量的平方根成反比。这个定律是...
- 发布于 2020-09-17 12:05
- 阅读 ( 644 )
理想气体定律(ideal gas law)和范德瓦尔斯方程(van der waals equation)的区别
关键区别——理想气体定律与范德瓦尔斯方程 理想气体定律是一个基本定律,而范德瓦尔斯方程是理想气体定律的修正版本。理想气体定律与范德瓦尔斯方程的主要区别在于,理想气体定律方程适用于理想气体,而范德瓦尔...
- 发布于 2020-10-19 04:40
- 阅读 ( 761 )
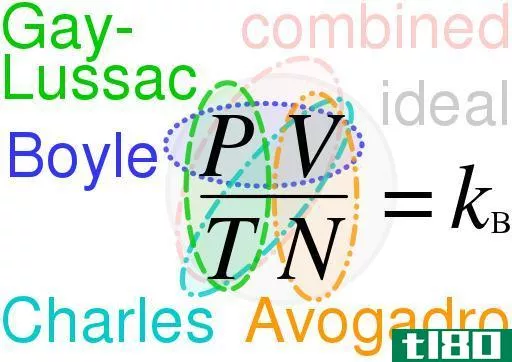
混合气体定律(combined gas law)和理想气体定律(ideal gas law)的区别
关键区别-组合气体定律与理想气体定律 在研究不同气体时,气体的体积、压力、温度和气体存在量之间的关系非常重要。这些关系由理想气体定律和组合气体定律给出。在解释这些定律时,通常使用“理想气体”一词。理想...
- 发布于 2020-10-19 04:51
- 阅读 ( 621 )
理想气体定律(ideal gas law)和真实气体定律(real gas law)的区别
理想气体定律和真实气体定律的关键区别在于,理想气体定律描述的是理论气体的行为,而真实气体定律描述的是宇宙中实际存在的气体的行为。 理想气体是一种理论气体,其随机运动的气体粒子之间没有其他相互作用,而...
- 发布于 2020-10-20 21:30
- 阅读 ( 864 )
同性恋法律(gay-lussac law)和帕斯卡原理(pascal principle)的区别
Gay-Lussac定律与Pascal原理的主要区别在于Gay-Lussac定律主要关注气体的性质,而Pascal法则则关注流体的性质。 Gay-Lussac定律和Pascal原理是我们在物理学中讨论的两个重要概念。Gay-Lussac定律对于描述气体的性质是非常重要的。帕斯...
- 发布于 2020-10-27 14:13
- 阅读 ( 711 )
亨利定律(henry’s law)和拉乌尔定律(raoult’s law)的区别
...的关系,它们之间是相互平衡的。亨利定律可以用来解释气体在液体溶剂(如水)中的溶解。拉乌尔特定律表明溶剂在一个与蒸汽压力平衡的溶液中的行为。然而,在实际解决方案中应用这些法律时,存在一定的局限性。亨利定...
- 发布于 2021-06-29 11:05
- 阅读 ( 913 )
常见的一般化学问题列表
...以根据问题的类型浏览化学问题。 a:绝对误差b:波义耳气体定律 绝对误差 准确性审查 酸碱滴定 活化能计算 两个向量之间的角度 水溶液稀释 原子质量概述 原子质量和同位素丰度 从原子丰度看原子质量 原子量计算 一组数字...
- 发布于 2021-09-08 10:26
- 阅读 ( 252 )
化学的主要规律
...创造也不能被毁灭。这个定律也被称为能量守恒定律。 Gay-Lussac定律气体的结合体积和产物(如果是气体)之间的比率可以用小整数表示。 格雷厄姆定律气体的扩散或渗出速率与其分子质量的平方根成反比。 亨利定律气体...
- 发布于 2021-09-15 12:45
- 阅读 ( 183 )
气体研究指南
气体的性质 气体是物质的一种状态。组成气体的粒子范围从单个原子到复杂分子。其他一些涉及气体的一般信息: 气体具有其容器的形状和体积。 气体的密度比固相或液相低。 气体比固相或液相更容易压缩。 当限制...
- 发布于 2021-09-15 12:46
- 阅读 ( 229 )
查尔斯定律的例子问题
查尔斯定律是理想气体定律的一个特例,其中气体的压力是恒定的。查尔斯定律指出,体积与恒压下气体的绝对温度成正比。只要气体的压力和数量不变,气体的温度加倍,其体积就会加倍。 查尔斯定律的例子问题 该示例...
- 发布于 2021-09-15 12:47
- 阅读 ( 342 )