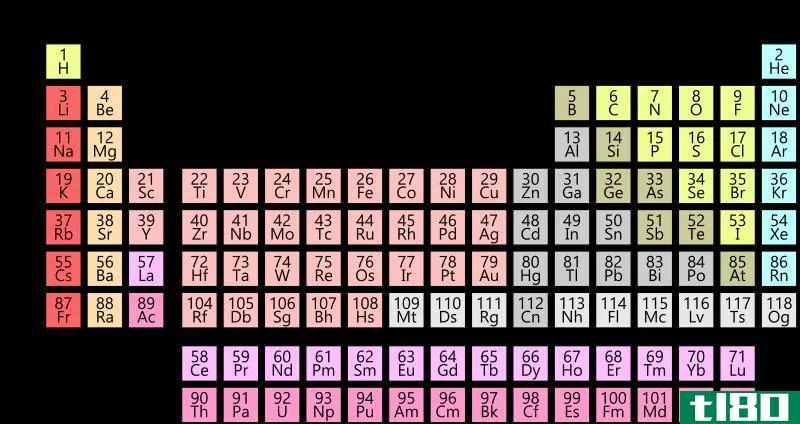
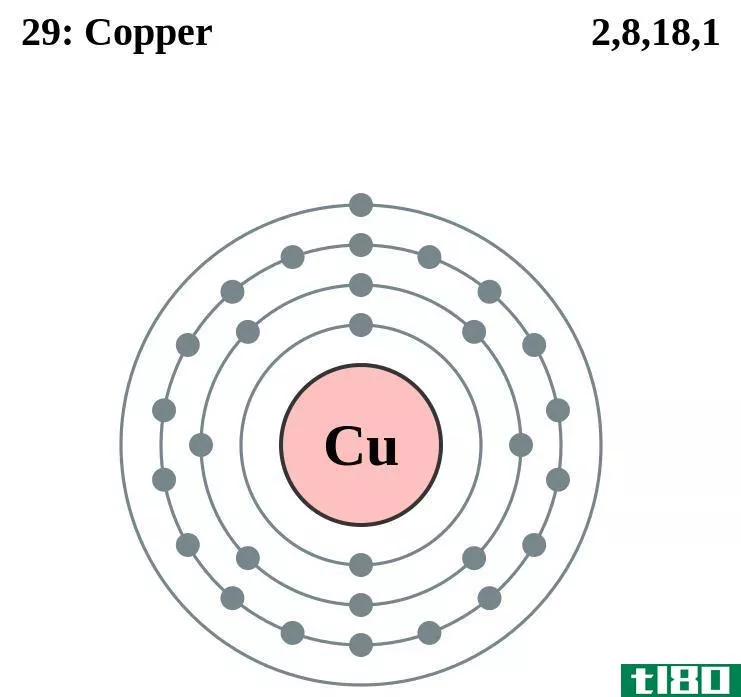
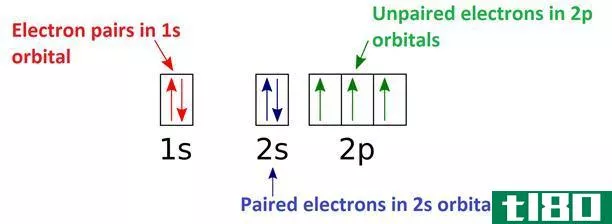
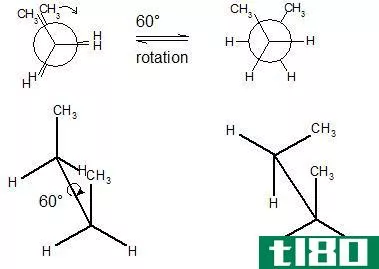
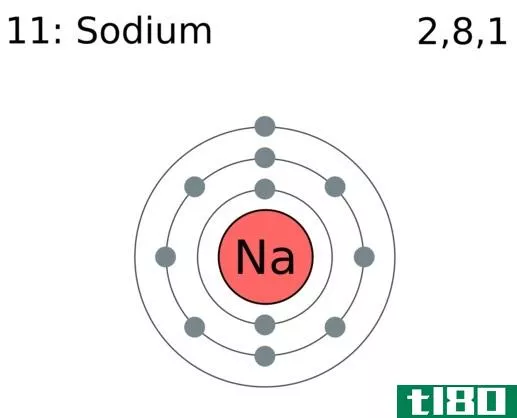
电子构型图
任何元素的原子的电子构型都是原子基态中每一能级的电子数。这张方便的图表汇集了104号元素的电子构型。

关键收获:电子构型
- 原子的电子构型描述了当原子处于基态时,其电子填充子能级的方式。
- 原子寻求最稳定的电子构型,因此只要可能,子能级都是半填充或完全填充的。
- 科学家们没有写出整个电子构型,而是使用一种简写符号,以元素周期表中元素之前的惰性气体符号开始。
如何确定电子构型
要得到原子的电子构型,你必须知道不同子能级的填充顺序。电子按能量增加的顺序进入可用的子能级。在输入下一个子级别之前,已填充或半填充子级别。
例如,s子能级只能容纳两个电子,因此1s中充满了氦(1s2)。p子能级可以容纳6个电子,d子能级可以容纳10个电子,f子能级可以容纳14个电子。常用的简写符号是指惰性气体堆芯,而不是写出整个配置。例如,镁的配置可以写入[Ne]3s2,而不是写入1S222P63S2。
电子构型图
| 不 | 要素 | K | L | M | N | o | P | Q |
|---|---|---|---|---|---|---|---|---|
| 1. | 2. | 3. | 4. | 5. | 6. | 7. | ||
| s | 标准普尔 | s p d | s p d f | s p d f | s p d f | s | ||
| 1. | H | 1. | ||||||
| 2. | 他 | 2. | ||||||
| 3. | 锂 | 2. | 1. | |||||
| 4. | 是 | 2. | 2. | |||||
| 5. | B | 2. | 2 1 | |||||
| 6. | C | 2. | 2 2 | |||||
| 7. | N | 2. | 2 3 | |||||
| 8. | O | 2. | 2 4 | |||||
| 9 | F | 2. | 2 5 | |||||
| 10 | 氖 | 2. | 2 6 | |||||
| 11 | Na | 2. | 2 6 | 1. | ||||
| 12 | 镁 | 2. | 2 6 | 2. | ||||
| 13 | 艾尔 | 2. | 2 6 | 2 1 | ||||
| 14 | 硅 | 2. | 2 6 | 2 2 | ||||
| 15 | P | 2. | 2 6 | 2 3 | ||||
| 16 | s | 2. | 2 6 | 2 4 | ||||
| 17 | 氯 | 2. | 2 6 | 2 5 | ||||
| 18 | 应收账 | 2. | 2 6 | 2 6 | ||||
| 19 | K | 2. | 2 6 | 2 6 - | 1. | |||
| 20 | Ca | 2. | 2 6 | 2 6 - | 2. | |||
| 21 | Sc | 2. | 2 6 | 2 6 1 | 2. | |||
| 22 | 钛 | 2. | 2 6 | 2 6 2 | 2. | |||
| 23 | v | 2. | 2 6 | 2 6 3 | 2. | |||
| 24 | 铬 | 2. | 2 6 | 2 6 5* | 1. | |||
| 25 | 锰 | 2. | 2 6 | 2 6 5 | 2. | |||
| 26 | 铁 | 2. | 2 6 | 2 6 6 | 2. | |||
| 27 | 有限公司 | 2. | 2 6 | 2 6 7 | 2. | |||
| 28 | 镍 | 2. | 2 6 | 2 6 8 | 2. | |||
| 29 | 铜 | 2. | 2 6 | 2 6 10 | 1* | |||
| 30 | 锌 | 2. | 2 6 | 2 6 10 | 2. | |||
| 31 | Ga | 2. | 2 6 | 2 6 10 | 2 1 | |||
| 32 | 通用电气 | 2. | 2 6 | 2 6 10 | 2 2 | |||
| 33 | 作为 | 2. | 2 6 | 2 6 10 | 2 3 | |||
| 34 | 硒 | 2. | 2 6 | 2 6 10 | 2 4 | |||
| 35 | 溴 | 2. | 2 6 | 2 6 10 | 2 5 | |||
| 36 | 韩元 | 2. | 2 6 | 2 6 10 | 2 6 | |||
| 37 | 铷 | 2. | 2 6 | 2 6 10 | 2 6 - | 1. | ||
| 38 | Sr | 2. | 2 6 | 2 6 10 | 2 6 - | 2. | ||
| 39 | Y | 2. | 2 6 | 2 6 10 | 2 6 1 | 2. | ||
| 40 | 锆 | 2. | 2 6 | 2 6 10 | 2 6 2 | 2. | ||
| 41 | 铌 | 2. | 2 6 | 2 6 10 | 2 6 4* | 1. | ||
| 42 | 钼 | 2. | 2 6 | 2 6 10 | 2 6 5 | 1. | ||
| 43 | Tc | 2. | 2 6 | 2 6 10 | 2 6 6 | 1. | ||
| 44 | 茹 | 2. | 2 6 | 2 6 10 | 2 6 7 | 1. | ||
| 45 | 相对湿度 | 2. | 2 6 | 2 6 10 | 2 6 8 | 1. | ||
| 46 | Pd | 2. | 2 6 | 2 6 10 | 2 6 10 | 0* | ||
| 47 | 银 | 2. | 2 6 | 2 6 10 | 2 6 10 | 1. | ||
| 48 | 光盘 | 2. | 2 6 | 2 6 10 | 2 6 10 | 2. | ||
| 49 | 在里面 | 2. | 2 6 | 2 6 10 | 2 6 10 | 2 1 | ||
| 50 | 锡 | 2. | 2 6 | 2 6 10 | 2 6 10 | 2 2 | ||
| 51 | 某人 | 2. | 2 6 | 2 6 10 | 2 6 10 | 2 3 | ||
| 52 | Te | 2. | 2 6 | 2 6 10 | 2 6 10 | 2 4 | ||
| 53 | 我 | 2. | 2 6 | 2 6 10 | 2 6 10 | 2 5 | ||
| 54 | 氙 | 2. | 2 6 | 2 6 10 | 2 6 10 | 2 6 | ||
| 55 | 铯 | 2. | 2 6 | 2 6 10 | 2 6 10 | 2 6 - - | 1. | |
| 56 | 文学士 | 2. | 2 6 | 2 6 10 | 2 6 10 | 2 6 - - | 2. | |
| 57 | 洛杉矶 | 2. | 2 6 | 2 6 10 | 2 6 10 - | 2 6 1 - | 2. | |
| 58 | 总工程师 | 2. | 2 6 | 2 6 10 | 2 6 10 2* | 2 6 - - | 2. | |
| 59 | 公共关系 | 2. | 2 6 | 2 6 10 | 2 6 10 3 | 2 6 - - | 2. | |
| 60 | 钕 | 2. | 2 6 | 2 6 10 | 2 6 10 4 | 2 6 - - | 2. | |
| 61 | 下午 | 2. | 2 6 | 2 6 10 | 2 6 10 5 | 2 6 - - | 2. | |
| 62 | 钐 | 2. | 2 6 | 2 6 10 | 2 6 10 6 | 2 6 - - | 2. | |
| 63 | 欧盟 | 2. | 2 6 | 2 6 10 | 2 6 10 7 | 2 6 - - | 2. | |
| 64 | 钆 | 2. | 2 6 | 2 6 10 | 2 6 10 7 | 2 6 1 - | 2. | |
| 65 | 结核病 | 2. | 2 6 | 2 6 10 | 2 6 10 9* | 2 6 - - | 2. | |
| 66 | Dy | 2. | 2 6 | 2 6 10 | 2 6 10 10 | 2 6 - - | 2. | |
| 67 | 霍 | 2. | 2 6 | 2 6 10 | 2 6 10 11 | 2 6 - - | 2. | |
| 68 | 铒 | 2. | 2 6 | 2 6 10 | 2 6 10 12 | 2 6 - - | 2. | |
| 69 | 商标 | 2. | 2 6 | 2 6 10 | 2 6 10 13 | 2 6 - - | 2. | |
| 70 | 镱 | 2. | 2 6 | 2 6 10 | 2 6 10 14 | 2 6 - - | 2. | |
| 71 | 鲁 | 2. | 2 6 | 2 6 10 | 2 6 10 14 | 2 6 1 - | 2. | |
| 72 | 高频 | 2. | 2 6 | 2 6 10 | 2 6 10 14 | 2 6 2 - | 2. | |
| 73 | 助教 | 2. | 2 6 | 2 6 10 | 2 6 10 14 | 2 6 3 - | 2. | |
| 74 | W | 2. | 2 6 | 2 6 10 | 2 6 10 14 | 2 6 4 - | 2. | |
| 75 | 重新 | 2. | 2 6 | 2 6 10 | 2 6 10 14 | 2 6 5 - | 2. | |
| 76 | 操作系统 | 2. | 2 6 | 2 6 10 | 2 6 10 14 | 2 6 6 - | 2. | |
| 77 | 红外光谱 | 2. | 2 6 | 2 6 10 | 2 6 10 14 | 2 6 7 - | 2. | |
| 78 | Pt | 2. | 2 6 | 2 6 10 | 2 6 10 14 | 2 6 9 - | 1. | |
| 79 | 金 | 2. | 2 6 | 2 6 10 | 2 6 10 14 | 2 6 10 - | 1. | |
| 80 | 汞 | 2. | 2 6 | 2 6 10 | 2 6 10 14 | 2 6 10 - | 2. | |
| 81 | 热释光 | 2. | 2 6 | 2 6 10 | 2 6 10 14 | 2 6 10 - | 2 1 - - | |
| 82 | PB | 2. | 2 6 | 2 6 10 | 2 6 10 14 | 2 6 10 - | 2 2 - - | |
| 83 | 毕 | 2. | 2 6 | 2 6 10 | 2 6 10 14 | 2 6 10 - | 2 3 - - | |
| 84 | Po | 2. | 2 6 | 2 6 10 | 2 6 10 14 | 2 6 10 - | 2 4 - - | |
| 85 | 在 | 2. | 2 6 | 2 6 10 | 2 6 10 14 | 2 6 10 - | 2 5 - - | |
| 86 | 注册护士 | 2. | 2 6 | 2 6 10 | 2 6 10 14 | 2 6 10 - | 2 6 - - | |
| 87 | Fr | 2. | 2 6 | 2 6 10 | 2 6 10 14 | 2 6 10 - | 2 6 - - | 1. |
| 88 | 类风湿关节炎 | 2. | 2 6 | 2 6 10 | 2 6 10 14 | 2 6 10 - | 2 6 - - | 2. |
| 89 | 交流电 | 2. | 2 6 | 2 6 10 | 2 6 10 14 | 2 6 10 - | 2 6 1 - | 2. |
| 90 | Th | 2. | 2 6 | 2 6 10 | 2 6 10 14 | 2 6 10 - | 2 6 2 - | 2. |
| 91 | 帕 | 2. | 2 6 | 2 6 10 | 2 6 10 14 | 2 6 10 2* | 2 6 1 - | 2. |
| 92 | U | 2. | 2 6 | 2 6 10 | 2 6 10 14 | 2 6 10 3 | 2 6 1 - | 2. |
| 93 | NP | 2. | 2 6 | 2 6 10 | 2 6 10 14 | 2 6 10 4 | 2 6 1 - | 2. |
| 94 | 聚氨基甲酸酯 | 2. | 2 6 | 2 6 10 | 2 6 10 14 | 2 6 10 6 | 2 6 - - | 2. |
| 95 | 是 | 2. | 2 6 | 2 6 10 | 2 6 10 14 | 2 6 10 7 | 2 6 - - | 2. |
| 96 | 厘米 | 2. | 2 6 | 2 6 10 | 2 6 10 14 | 2 6 10 7 | 2 6 1 - | 2. |
| 97 | Bk | 2. | 2 6 | 2 6 10 | 2 6 10 14 | 2 6 10 9* | 2 6 - - | 2. |
| 98 | 查阅 | 2. | 2 6 | 2 6 10 | 2 6 10 14 | 2 6 10 10 | 2 6 - - | 2. |
| 99 | 锿 | 2. | 2 6 | 2 6 10 | 2 6 10 14 | 2 6 10 11 | 2 6 - - | 2. |
| 100 | 调频 | 2. | 2 6 | 2 6 10 | 2 6 10 14 | 2 6 10 12 | 2 6 - - | 2. |
| 101 | 医学博士 | 2. | 2 6 | 2 6 10 | 2 6 10 14 | 2 6 10 13 | 2 6 - - | 2. |
| 102 | 不 | 2. | 2 6 | 2 6 10 | 2 6 10 14 | 2 6 10 14 | 2 6 - - | 2. |
| 103 | Lr | 2. | 2 6 | 2 6 10 | 2 6 10 14 | 2 6 10 14 | 2 6 1 - | 2. |
| 104 | 射频 | 2. | 2 6 | 2 6 10 | 2 6 10 14 | 2 6 10 14 | 2 6 2 - | 2. |
*注意不规则性
如果需要,您也可以在可打印的周期表上查看元素的电子配置。
- 发表于 2021-09-16 14:12
- 阅读 ( 182 )
- 分类:化学
你可能感兴趣的文章
八位元(octet)和二分体(duplet)的区别
...非活性原子或化合物。这个特性主要取决于原子最外层的电子数。具有不完整壳层的原子可能会变得活跃,以完成它们的电子构型,从而变得稳定。不活泼的原子有一个完整的电子构型;因此,这些原子不与任何其他原子发生反...
- 发布于 2020-09-24 23:14
- 阅读 ( 1770 )
构型熵(configurational entropy)和热熵(thermal entropy)的区别
构型熵和热熵的关键区别在于,构型熵是指在没有温度交换的情况下所做的功,而热熵是指在温度交换的情况下所做的功。 在这里,熵是一个热力学系统随机性的度量。随机性的增加是指熵的增加,反之亦然。 目录 1. 概述...
- 发布于 2020-09-26 17:30
- 阅读 ( 1573 )
18电子法则(18 electron rule)和ean规则(ean rule)的区别
18电子规则和EAN规则的关键区别在于,18电子规则表明金属配位络合物周围必须有18个价电子才能稳定,而EAN规则则描述了金属原子必须获得同一时期存在的稀有气体的电子构型,以便变得稳定。 18电子规则和EAN规则都表明,...
- 发布于 2020-10-15 06:07
- 阅读 ( 729 )
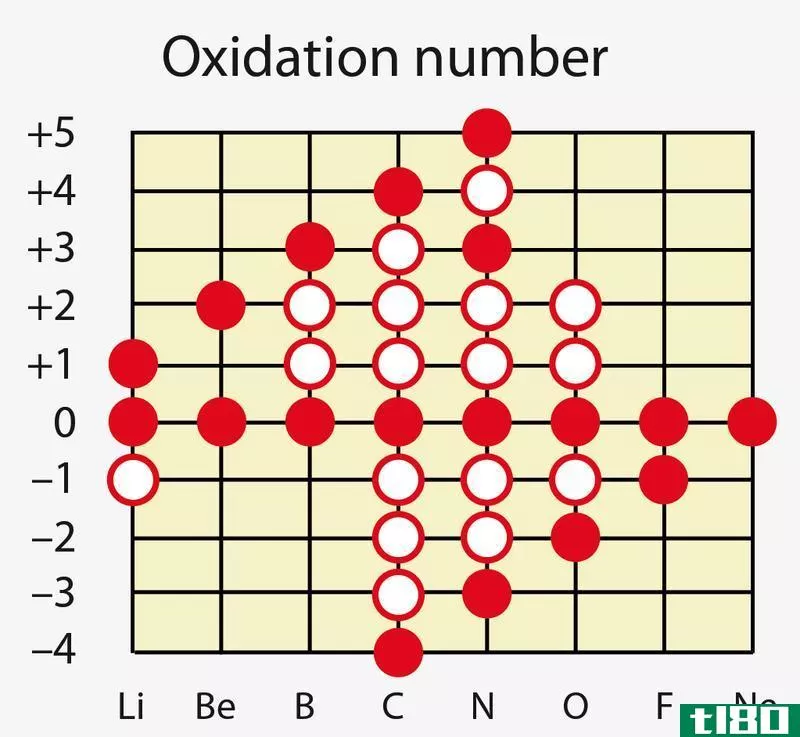
价(valency)和氧化值(oxidation number)的区别
...于,价态是一个原子为稳定所能失去、获得或共享的最大电子数,而氧化数是一个原子为了与另一个原子形成键而可以失去或获得的电子数。 氧化数和价电子与原子的价电子有关。价电子是占据原子最外层轨道的电子。这些电...
- 发布于 2020-10-15 12:44
- 阅读 ( 311 )
第一秒(first second)和第三过渡系列(third transition series)的区别
...期的金属,其中包含过渡金属。因此,当考虑这些元素的电子组态时,所有这些元素都有3d和4s电子。这意味着这些元素最外层的d轨道是3d轨道。此外,这一系列的元素包含一个完整的氩电子结构,其中有3d和4s电子。 图01:元素...
- 发布于 2020-10-15 14:56
- 阅读 ( 269 )
亚铜(cuprous)和铜(cupric)的区别
...离子为亚铜阳离子和铜阳离子。亚铜和铜离子根据它们的电子构型而不同。铜和铜的主要区别在于,亚铜是铜1+阳离子,而铜是铜+2阳离子。 目录 1.概述和主要区别 2. 什么是铜 3. 铜是什么 4. 铜与铜的相似性 5. 并列比较-亚铜...
- 发布于 2020-10-16 10:30
- 阅读 ( 271 )
成对的(paired)和未成对电子(unpaired electrons)的区别
原子中成对的电子在轨道上以成对的形式出现,但未成对的电子不会以电子对或成对的形式出现。成对电子和未成对电子之间的关键区别在于,成对电子引起原子的抗磁性,而未成对电子引起原子的顺磁性或铁磁性。 电子是...
- 发布于 2020-10-17 13:03
- 阅读 ( 834 )
构象(conformation)和配置(configuration)的区别
构象和构型的关键区别在于同一分子的构象迅速相互转换,而同一分子的构型不容易相互转换。 构象和构型两个术语都描述了一个特定分子的空间排列。我们主要在有机化学中使用这些术语来确定有机化合物中原子的空间排...
- 发布于 2020-10-17 15:07
- 阅读 ( 1781 )
钙(calcium)和镁(magnesium)的区别
...中,但它们处于周期表的不同时期,因为钙比镁多了一个电子壳层。因此,它们具有不同的化学和物理性质。 目录 1. 概述和主要区别 2. 什么是钙 3. 什么是镁 4. 钙和镁的相似性 5. 并列比较-钙和镁的表格形式 6. 摘要 什么是钙(ca...
- 发布于 2020-10-22 08:34
- 阅读 ( 676 )
原子价(valence)和核心电子(core electrons)的区别
价电子和核心电子之间的关键区别在于,价电子参与化学键的形成,而核心电子不参与化学键的形成。 原子是所有现存物质的组成部分。它们太小了,我们甚至不能用肉眼观察它们。一般来说,原子在埃范围内。原子是由原...
- 发布于 2020-10-22 12:42
- 阅读 ( 1136 )