1秒(1s)和2s轨道(2s orbital)的区别
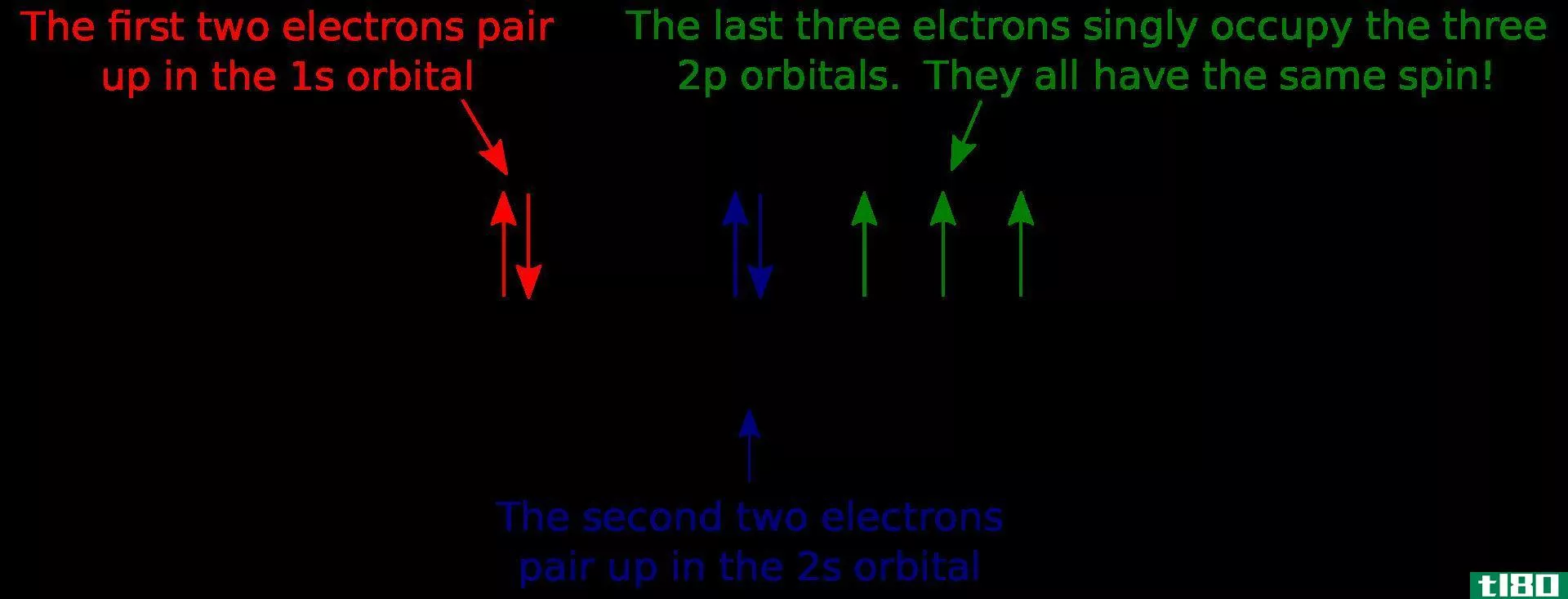
原子是物质的最小单位。换句话说,所有物质都是由原子构成的。原子由亚原子粒子组成,主要是质子、电子和中子。质子和电子使原子核位于原子中心。但是电子被定位在位于原子核外的轨道(或能级)。另外,还必须注意,轨道是用来解释原子最可能位置的假设概念。围绕核有各种轨道。也有s、p、d、f等子轨道,s子轨道在被视为三维结构时呈球形。s轨道在核周围发现电子的概率最高。子轨道又根据能量水平被编号为1s、2s、3s等。1s和2s轨道的关键区别是每个轨道的能量。1s轨道的能量比2s轨道低。
内容1。概述和主要区别2。什么是1s轨道。什么是2s轨道4。并排比较——1s与2s轨道5。摘要
什么是1s轨道(1s orbital)?
1s轨道是离原子核最近的轨道。它的能量是其他轨道中最低的。它也是最小的球形。因此,s轨道的半径很小。在s轨道上只能有2个电子。如果s轨道上只有一个电子,则电子构型可以写成1s1。但是如果有一对电子,可以写成1s2。然后,s轨道上的两个电子,由于两个电子的相同电荷所产生的斥力,向相反的方向移动。当有一个不成对的电子时,它被称为顺磁性。那是因为它可以被磁铁吸引。但是,如果轨道被填满并且有一对电子存在,电子就不能被磁铁吸引,这就是所谓的反磁性。
什么是2s轨道(2s orbital)?
2s轨道大于1s轨道。因此,它的半径大于1s轨道的半径。它是继1s轨道后,下一个接近核的秘密轨道。它的能量高于1s轨道,但低于原子的其他轨道。2s轨道也只能填充一个或两个电子。但2s轨道只有在1s轨道完成后才充满电子。这就是所谓的Aufbau原理,它表示电子填充到子轨道的顺序。
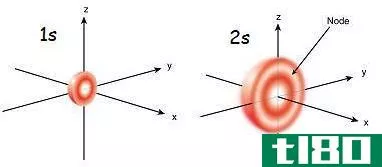
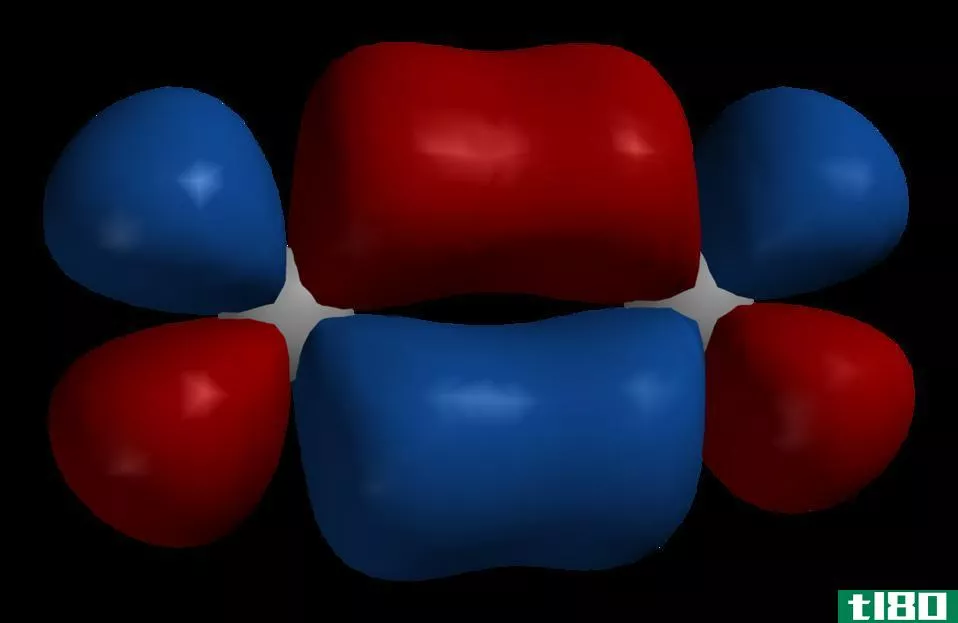
图01:1s和2s轨道
1秒(1s)和2s轨道(2s orbital)的区别
| 1s vs 2s轨道 | |
| 1s轨道是离核最近的轨道。 | 2s轨道是距离原子核第二近的轨道。 |
| 能级 | |
| 1s轨道的能量低于2s轨道的能量。 | 2s的能量相对较高。 |
| 轨道半径 | |
| 1s轨道的半径较小。 | 2s轨道半径较大。 |
| 轨道大小 | |
| 1s轨道具有最小的球形。 | 2s轨道大于1s轨道。 |
| 电子填充 | |
| 电子首先填充在1s轨道上。 | 2s轨道只有在1s轨道中的电子完成后才被填满。 |
总结 - 1秒(1s) vs. 2s轨道(2s orbital)
原子是一个三维结构,中心有一个原子核,周围环绕着各种形状的不同能级的轨道。根据能量的细微差别,这些轨道又被分为子轨道。电子是原子的主要亚原子粒子,位于这些能级上。1s和2s子轨道离原子核最近。1s轨道与2s轨道的主要区别在于其能级的差异,即2s轨道比1s轨道具有更高的能级。
参考文献:1。歌词。“原子轨道”,化学剧本。歌词,2015年11月3日。网状物。2017年5月26日。<;https://chem.libretexts.org/Core/Physical_and_theory_Chemistry/Electronic_Structure of_Atoms_and_Molecules/Atomic_轨道>;。2。原子、电子和轨道。N、 p.,N.d.网络。2017年5月26日。<;http://www.mhe.com/physci/chemistry/carey/student/olc/ch01atoms.html>;。