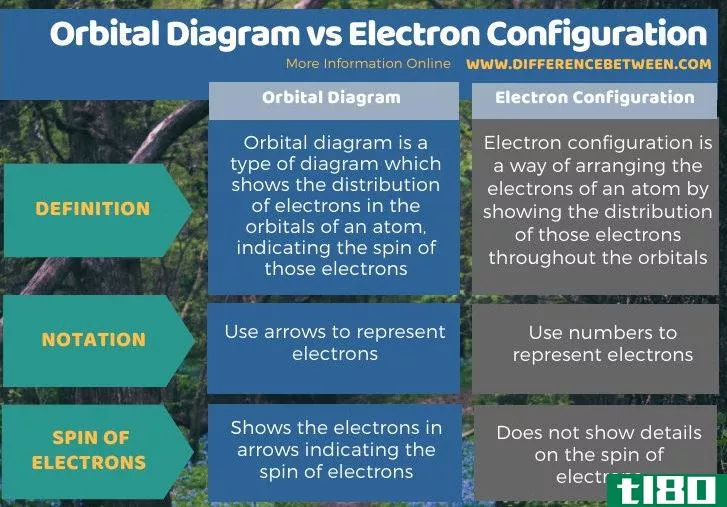
轨道图和电子构型的关键区别在于,轨道图用箭头表示电子,表示电子的自旋。但是,电子组态没有显示电子自旋的细节。
轨道图显示了由电子组态给出的电子排列。电子组态给出了电子在整个原子轨道上分布的细节。但是,轨道图也显示了电子的自旋。这就是轨道图和电子构型的基本区别。
目录
1. 概述和主要区别
2. 什么是轨道图
3. 什么是电子构型
4. 并排比较-轨道图与表格形式的电子构型
6. 摘要
什么是轨道图(orbital diagram)?
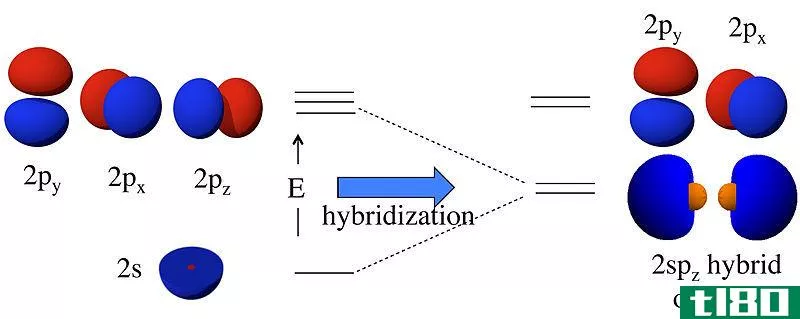
轨道图是一种显示电子在原子轨道上的分布并指示这些电子的自旋的图表。它是一种表示哪些轨道被填充,哪些轨道被部分填充的符号。这里,我们用箭头来表示电子。箭头的方向(向上或向下)表示电子的自旋。
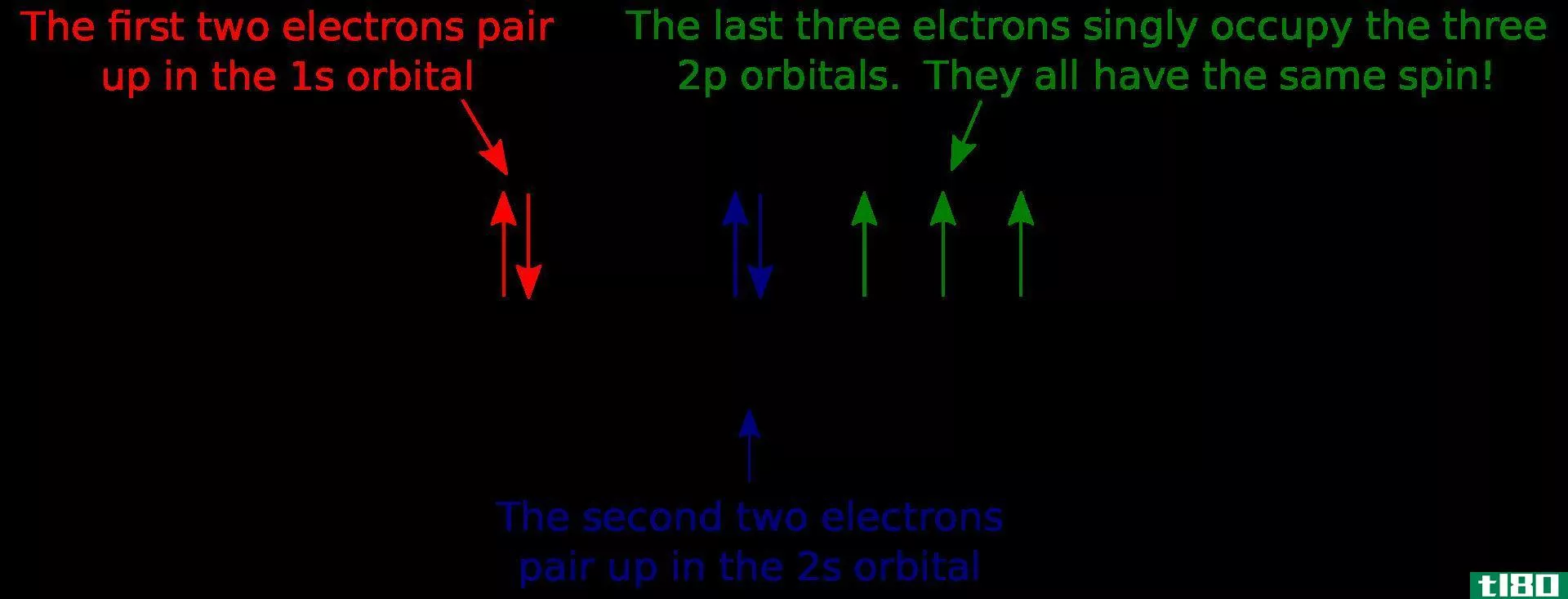
图01:氮的轨道图
一个轨道最多可以有两个电子。根据泡利不相容原理,同一原子中的两个电子不能有相同的量子数集。这意味着,即使所有其他量子数相同,自旋量子数也不同。同一轨道上的两个电子自旋相反。上图显示了一个轨道图的例子。
什么是电子组态(electron configuration)?
电子组态是通过显示电子在轨道上的分布来排列原子中的电子的一种方法。早些时候,电子组态是用原子的玻尔模型发展出来的。这对于电子较少的小原子来说是准确的,但是当考虑具有大量电子的大原子时,我们必须使用量子理论来确定电子分布。
根据量子力学,电子壳层是多个电子共享同一主量子数的状态,我们用给定的能级数和我们考虑的轨道类型来命名壳层,例如2s是指第二能级电子壳层的s轨道。此外,还有一种模式可以描述一个电子壳层所能容纳的最大电子数。在这里,这个最大数取决于方位角量子数l。此外,l=0、1、2和3分别表示s、p、d和f轨道。一个壳层能容纳的最大电子数=2(2l+1)。因此,我们可以制定下表;
| 轨道 | 最大电子数2(2l+1) |
| L=0是s轨道 | 2 |
| L=1是p轨道 | 6 |
| L=2为d轨道 | 10 |
| L=3是f轨道 | 14 |
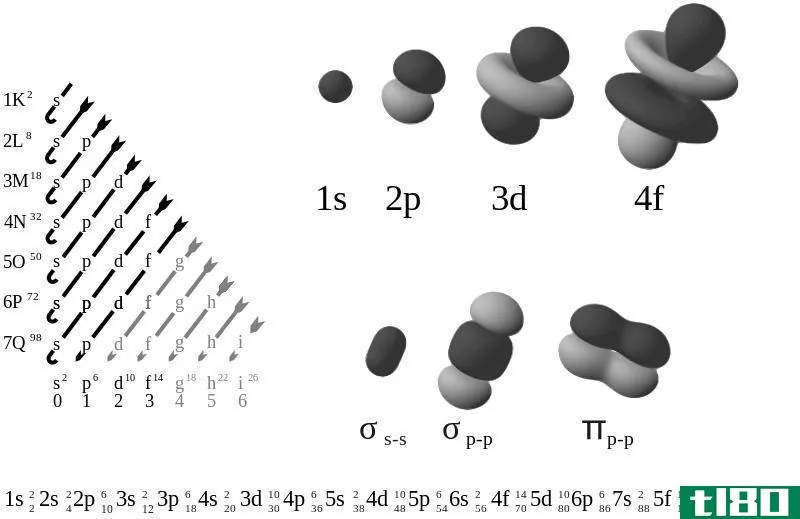
当考虑电子组态的符号时,我们需要使用量子数序列。例如,氢原子的电子构型是1s1。在这里,这个符号表示氢原子在第一个电子壳层的s轨道上有一个电子。对于磷,电子构型是1S22S2P63S2**3。也就是说,磷原子有3个电子壳层,里面装满了15个电子。
轨道图(orbital diagram)和电子组态(electron configuration)的区别
轨道图显示了由电子组态给出的电子排列。轨道图和电子构型的关键区别在于,轨道图用箭头表示电子的自旋。同时,电子组态没有显示电子自旋的细节。此外,在符号模式中,轨道图用箭头来表示电子,而电子构型则用数字表示电子。
下面是轨道图和电子构型之间的区别总结。
总结 - 轨道图(orbital diagram) vs. 电子组态(electron configuration)
电子的轨道图并没有显示电子的自旋构型的细节,而电子的轨道图并没有显示电子之间的差异。
引用
1“1.4:电子构型和轨道图”,化学图书馆,图书馆,2019年9月26日,可在这里查阅。