轨道与轨道的关键区别在于,轨道是一条围绕中心点有固定路径的环形路径,而轨道是围绕原子核的不确定区域。
虽然术语“轨道”和“轨道”听起来相似,但这是两个不同的术语。轨道一词主要与行星有关,而轨道一词则与原子有关。另外,确定一个不确定物体的轨道运动是可能的。
目录
1. 概述和主要区别
2. 什么是轨道
3. 什么是轨道
4. 并列比较-以表格形式显示轨道与轨道
5. 摘要
什么是轨道(an orbit)?
轨道是物体的引力曲线轨迹,例如行星绕恒星的轨迹。这个术语主要属于物理,而不是化学。不过,让我们讨论一下这个话题的一些细节,以便了解轨道和轨道之间的区别。

图1:卫星以一定的轨道绕地球运行
通常,轨道指的是重复的轨迹。有时,它也可能指不重复的轨迹。轨道是看不见的,因为它是一条路径,而不是一个物体。但是,我们可以通过检查穿过这条路径的物体来确定这条路径的尺寸。像重力这样的力会产生这样的路径,把移动的物体拉成弯曲的/圆形的运动。
什么是轨道(an orbital)?
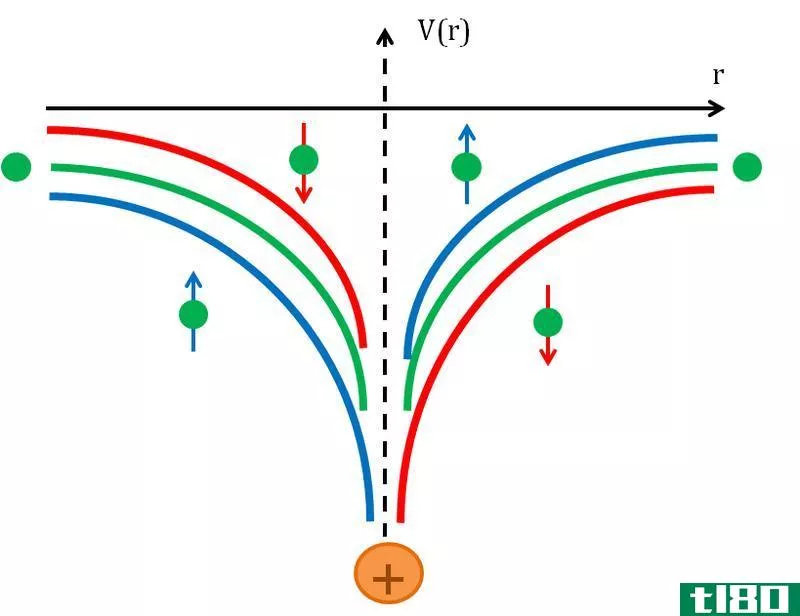
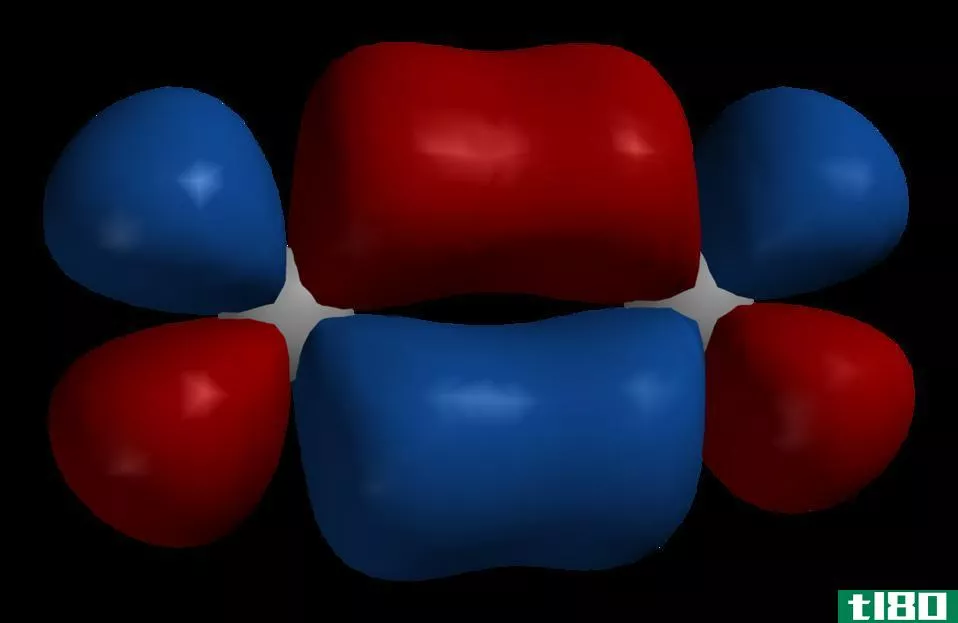
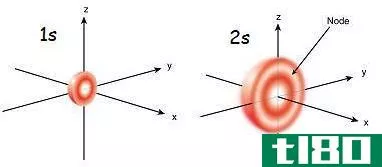
轨道是描述原子中单个电子或一对电子的波状行为的数学函数。基本上,它是我们在某一时刻,在某一点上能找到电子的区域。然而,电子的运动不是以固定的路径进行的。因此,轨道不是固定的环形轨道。此外,我们无法确定电子的确切位置或它的确切运动。我们只能确定在原子核周围找到电子的可能性。因此,轨道是原子中的一个特定区域。

图2:原子核周围的电子云
此外,我们可以用一组独特的值来详细描述原子轨道。我们称之为量子数。
1电子(n)2的能级。角动量数(l)3。磁量子数(m)4。自旋量子数
我们可以把原子轨道表示为围绕原子核的电子云。因此,轨道是原子中的一个特定区域。
轨道(orbit)和轨道(orbital)的区别
轨道是物体的引力曲线轨迹,例如行星绕恒星的轨迹,而轨道是描述原子中一个电子或一对电子波状行为的数学函数。因此,轨道与轨道的关键区别在于,轨道是一条围绕中心点有固定路径的环形路径,而轨道是围绕原子核的不确定区域。
轨道和轨道的一个显著区别是轨道是圆形的,而轨道没有明确的形状。例如,行星绕恒星运动,卫星绕行星运动等,都是通过轨道运动,而电子绕原子核运动则是通过轨道运动。
下面的信息图提供了更多关于轨道和轨道之间区别的细节。

总结 - 轨道(orbit) vs. 轨道(orbital)
轨道和轨道都是不可见的,因为它们不是物体而是路径。虽然这两个词听起来很相似,但它们彼此有很大的不同。轨道与轨道的关键区别在于,轨道是一条围绕中心点有固定路径的环形路径,而轨道是围绕原子核的不确定区域。
引用
1“轨道”,维基百科,维基媒体基金会,2019年4月27日,可在这里查阅。“原子轨道”,维基百科,维基媒体基金会,2019年4月18日,可在这里查阅。
2“原子轨道”,维基百科,维基媒体基金会,2019年4月18日,