分子轨道和原子轨道的关键区别在于,原子轨道描述的是原子中找到电子的概率很高的位置,而分子轨道描述的是分子中电子的可能位置。
利用薛定谔、海森堡和保罗·狄拉克提出的新理论,人们以一种新的方式来理解分子中的键合。当量子力学与他们的发现结合在一起时,人们发现电子既有粒子特性又有波特性。基于此,薛定谔发展了方程来发现电子的波动性质,并提出了波动方程和波函数。波函数(Ψ)对应于电子的不同状态。
目录
1. 概述和主要区别
2. 什么是分子轨道
3. 什么是原子轨道
4. 并列比较-分子轨道和原子轨道的表格形式
5. 摘要
什么是分子轨道(a molecular orbital)?
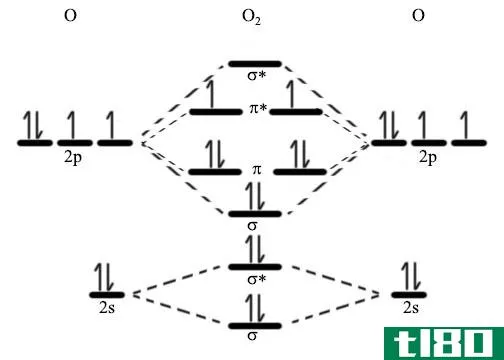
原子结合在一起形成分子。当两个原子靠得更近形成一个分子时,原子轨道重叠并结合成分子轨道。新形成的分子轨道数等于组合原子轨道数。此外,分子轨道环绕着两个原子核,电子可以绕着两个原子核移动。与原子轨道类似,分子轨道最多包含2个自旋相反的电子。
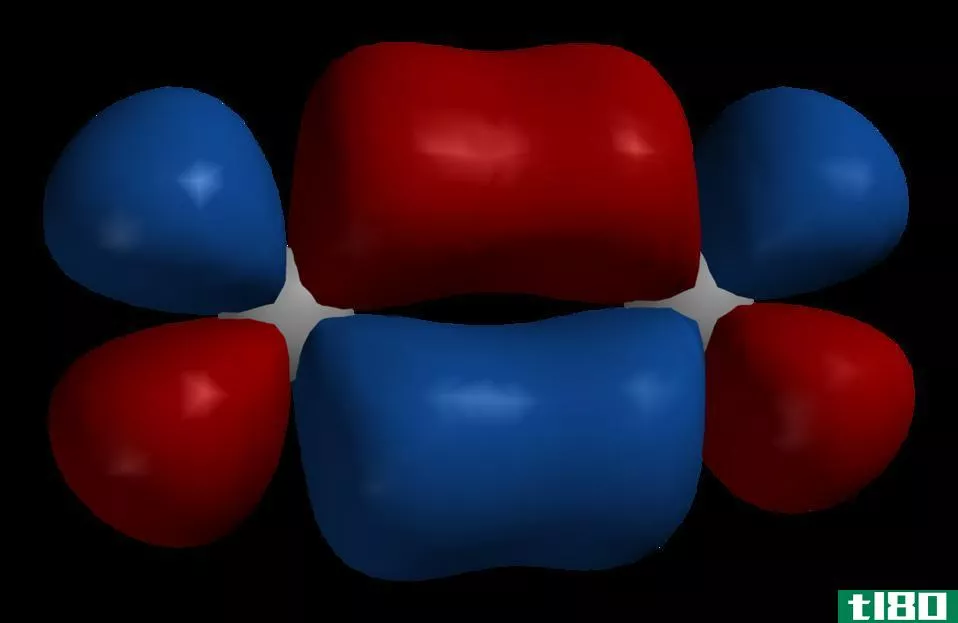
图01:分子中的分子轨道
此外,分子轨道有两种类型:成键分子轨道和反键分子轨道。成键分子轨道包含基态电子,而反键分子轨道不包含基态电子。此外,如果分子处于激发态,电子可能占据反键轨道。
什么是原子轨道(an atomic orbital)?
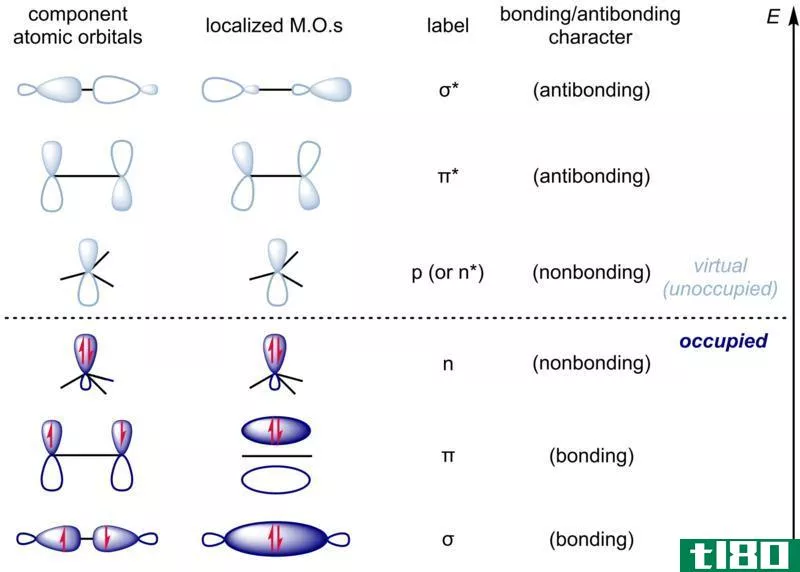
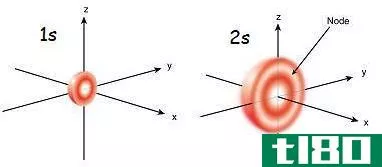
在薛定谔提出波函数Ψ2平方的理论后,马克斯·伯恩指出了波函数平方的物理意义。根据Born的说法,Ψ2表示在特定位置找到电子的概率;如果Ψ2是一个很大的值,那么在这个空间中找到电子的概率就更高。因此,在空间中,电子的概率密度很大。然而,如果Ψ2较低,则电子几率密度较低。Ψ2在x,y,z轴上的曲线图显示了这些概率,它们呈s,p,d和f轨道的形状。我们称之为原子轨道。

图02:不同的原子轨道
此外,我们将原子轨道定义为在原子中找到电子的概率很大的空间区域。我们可以用量子数来描述这些轨道,每个原子轨道可以容纳两个自旋相反的电子。例如,当我们写电子组态时,我们把它写成1s2,2s2,2p6,3s2。1,2,3….n整数值是量子数。轨道名称后的上标表示该轨道中的电子数。s轨道为球形,较小,P轨道为哑铃形,有两个叶瓣。这里,一个是正的,另一个是负的。另外,两个叶瓣互相接触的地方就是节点。有3个p轨道,如x,y和z,它们在空间中的排列方式是它们的轴相互垂直。
有5个d轨道和7个f轨道,形状不同。因此,下面是一个轨道上可以存在的电子总数。
- s轨道-2电子
- p轨道-6个电子
- d轨道-10个电子
- f轨道-14个电子
分子轨道(molecular orbital)和原子轨道(atomic orbital)的区别
分子轨道和原子轨道的关键区别在于,原子轨道描述的是原子中找到电子的概率很高的位置,而分子轨道描述的是分子中电子的可能位置。此外,原子轨道存在于原子中,而分子轨道存在于分子中。此外,原子轨道的结合导致了分子轨道的形成。此外,原子轨道被称为s、p、d和f,而分子轨道有两种类型,即成键和反键分子轨道。
总结 - 分子轨道(molecular orbital) vs. 原子轨道(atomic orbital)
分子轨道和原子轨道的关键区别在于,原子轨道描述的是原子中找到电子的概率很高的位置,而分子轨道描述的是分子中电子的可能位置。
引用
1赫尔曼斯汀,安妮·玛丽。“轨道定义和例子”,ThoughtCo,May。2019年7月7日,可在这里购买。