混合轨道和退化轨道的关键区别在于,混合轨道是两个或多个轨道混合形成的新轨道,而退化轨道最初存在于原子中。
正如它的名字所暗示的,混合轨道是两个或更多轨道的混合。虽然简并轨道的名称看起来是一样的,但它们不是新形成的轨道——它们已经存在于原子中。此外,分子中的所有杂化轨道都具有相同的能量,而原子中的简并轨道具有相同的能量。
目录
1. 概述和主要区别
2. 什么是杂化轨道
3. 什么是简并轨道
4. 并列比较-混合轨道与简并轨道的表格形式
5. 摘要
什么是杂化轨道(hybrid orbitals)?
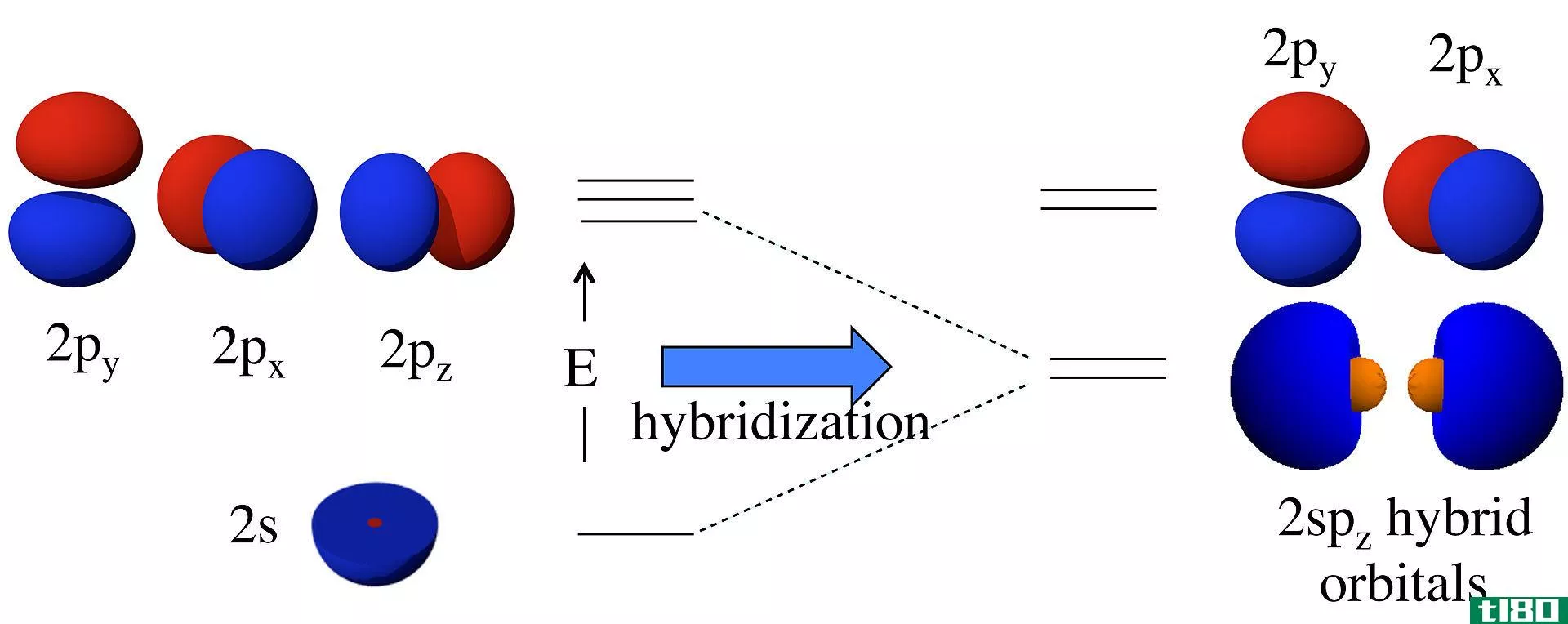
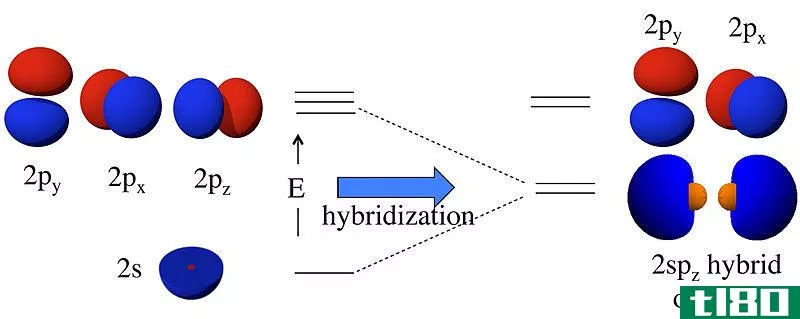
杂化轨道是由两个或多个原子轨道组合而成的轨道。我们称这种组合过程为杂交。在这些轨道形成之前,原子轨道可能具有不同的能量,但在形成之后,所有轨道的能量相同。例如,一个s原子轨道和一个p原子轨道可以组合成两个sp轨道。s和p原子轨道有不同的能量(s的能量,lt;p的能量)。但是,杂化的结果是形成两个具有相同能量的sp轨道;这个能量介于单个s和p原子轨道能量之间。此外,这个sp杂化轨道具有50%s轨道特性和50%p轨道特性。
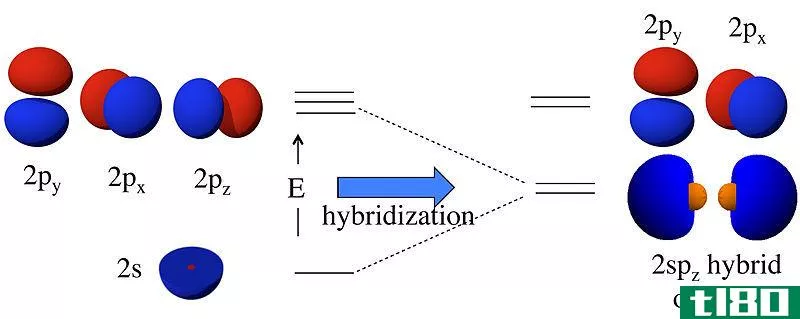
图01:Sp杂交
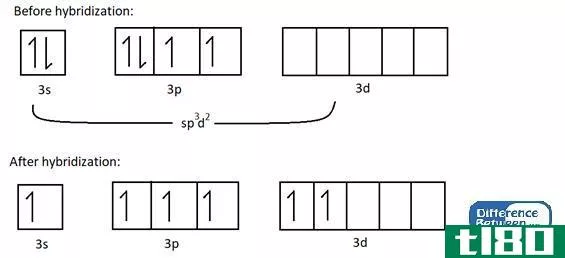
杂化的概念首先被讨论是因为科学家发现价键理论不能正确地预测某些分子如CH4的结构。虽然根据碳原子的电子构型,碳原子只有两个不成对的电子,但它可以形成四个共价键。为了形成四个键,必须有四个不成对的电子。解释这一现象的唯一方法是认为碳原子的s轨道和p轨道相互融合,形成新的轨道,称为杂化轨道,它们具有相同的能量。这里,一个s+3p给出了4个sp3轨道。因此,电子均匀地填充这些杂化轨道(每个杂化轨道有一个电子),遵循Hund规则。然后,有四个电子与四个氢原子形成四个共价键。
什么是简并轨道(degenerate orbitals)?
否认轨道是具有相同能量的原子轨道。例如,在p轨道亚壳层中,根据空间排列,有三个原子轨道彼此不同。虽然这三个p轨道的能量相同,但它们的排列方式不同,因此我们称它们为简并轨道。
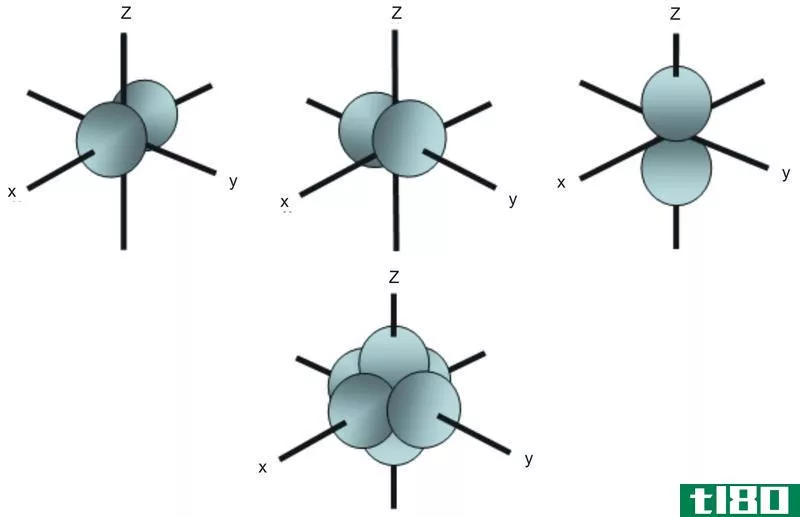
图02:三个p轨道的空间排列
然而,在外加磁场的存在下,我们可以消除简并。这是因为简并轨道在外磁场的作用下会得到不同的能量,它们不再是简并轨道。此外,d亚壳层中的五个d轨道也是简并轨道,因为它们具有相同的能量。
混合的(hybrid)和简并轨道(degenerate orbitals)的区别
杂化轨道和简并轨道的关键区别在于,杂化轨道是由两个或多个轨道混合而成的新轨道,而简并轨道是最初存在于原子中的轨道。此外,杂化轨道是分子轨道,而简并轨道是原子轨道。此外,杂化轨道是具有相同能量的分子轨道,而简并轨道是具有相同能量的原子轨道。例如,sp,sp2和sp3轨道是混合轨道,而p子壳层中有三个p轨道。

总结 - 混合的(hybrid) vs. 简并轨道(degenerate orbitals)
杂化轨道是分子轨道,而简并轨道是原子轨道。杂化轨道和简并轨道的关键区别在于,杂化轨道是由两个或多个轨道混合而成,而简并轨道最初存在于一个原子中。
引用
1赫尔曼斯汀,安妮·玛丽。“混合轨道定义”,ThoughtCo,2018年6月22日,可在这里查阅。