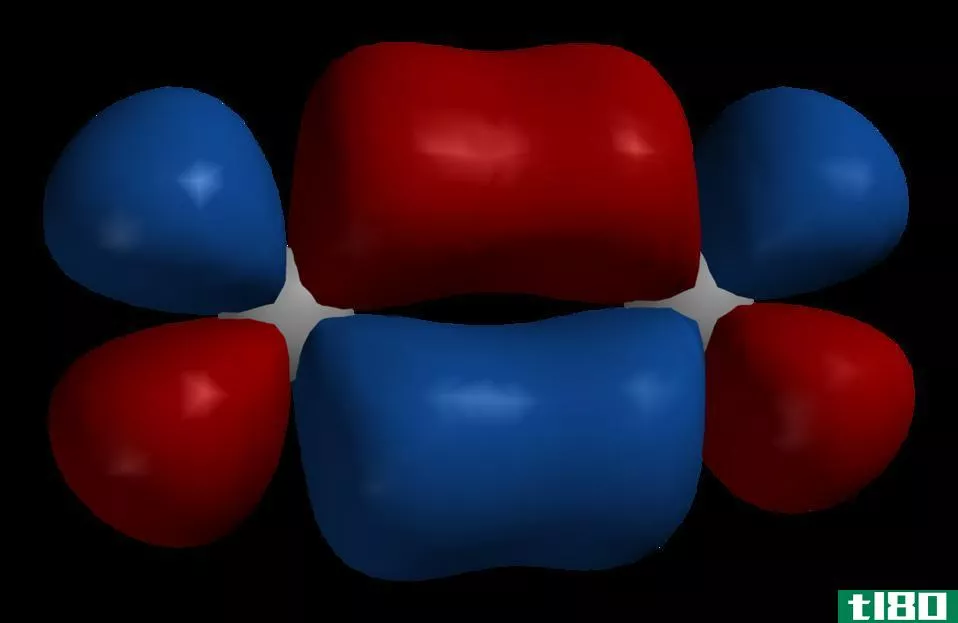
Px-Py和Pz轨道的关键区别在于Px轨道有两个沿x轴方向的波瓣,Py轨道有两个沿y轴方向的波瓣,而Pz轨道有两个沿z轴方向的波瓣。因此,Px-Py和Pz轨道之间的差异源于它们在空间中的取向。
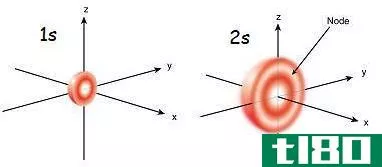
An atomic orbital is a region around an atomic nucleus, which has the highest probability of finding an electron. The orbitals of an atom can be either s orbital, p orbital, d orbital, or f orbital. Furthermore, there are three p orbitals; they are Px, Py and Pz orbitals.
目录
1. 概述和主要区别
2. 什么是Px轨道
3. 什么是Py轨道
4. 什么是Pz轨道
5. Px-Py和Pz轨道的相似性
6. 并列比较——Px、Py和Pz轨道的表格形式
7. 摘要
什么是px轨道(a px orbital)?
Px轨道是三个p轨道之一,沿x轴定向。此外,这个轨道有两个半球,呈哑铃状。量子数是一组有助于命名原子轨道的数字。这个系统给一个特定的原子轨道起了一个独特的名字。
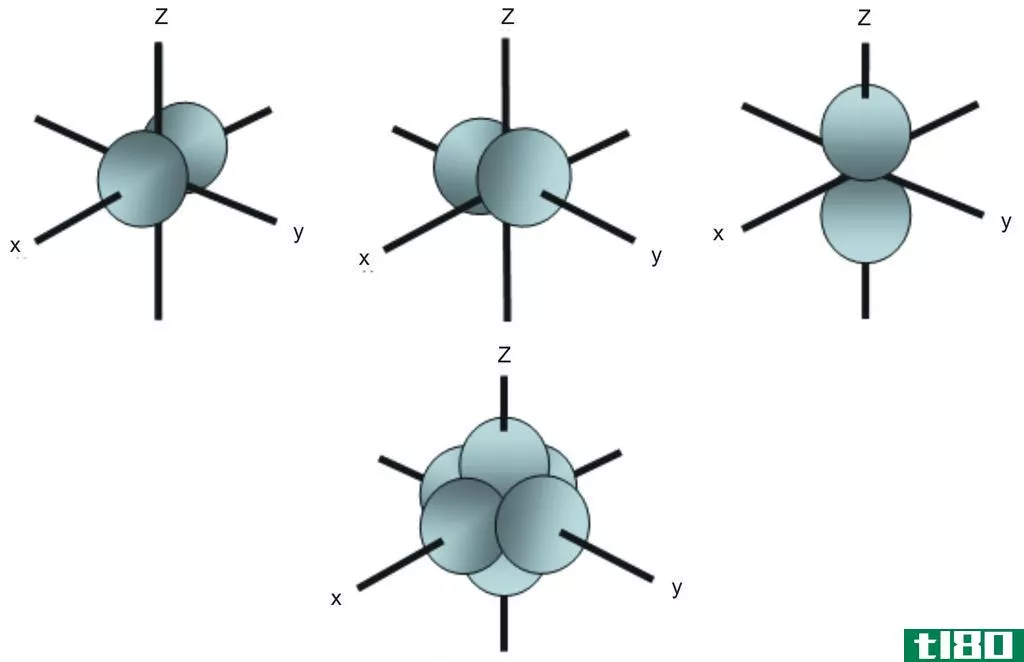
图1:不同的p轨道及其方向
量子数:
- 主量子数(n)描述了电子壳层。例:n=1,2,3…
- 方位角量子数或角动量量子数(l)解释了子壳层。例:l=0,1,2…
- 磁量子数(m)表示电子的唯一量子态。例:m=…-2,-1,0,+1,+2…
- 自旋量子数描述电子的自旋。示例:s=±
当考虑Px轨道时,量子表示法如下。
- 当n=1时,没有P轨道。
- 当n>2,l=1时,存在p轨道。那么,Px要么是m=+1,要么是m=-1。
- 随着n值的增加,Px轨道外叶的尺寸逐渐增大,而内叶的尺寸逐渐减小。
什么是一个py轨道(a py orbital)?
Py轨道是沿y轴定向的三个p轨道之一。这个轨道有两个叶瓣。Py轨道的量子表示法如下。
- 当n=1时,没有P轨道。
- 当n>2,l=1时,存在p轨道。那么,Py要么是m=+1,要么是m=-1。
- 随着n值的增加,Py轨道外叶的尺寸逐渐增大,而内叶的尺寸逐渐减小。
什么是pz轨道(a pz orbital)?
Pz轨道是沿z轴定向的三个p轨道之一。这个轨道有两个半球,呈哑铃状。Py轨道的量子表示法如下:
- 当n=1时,没有P轨道。
- 当n>2,l=1时,存在p轨道。则Pz为m=0。
- 随着n值的增加,Pz轨道外叶的尺寸逐渐增大,而内叶的尺寸逐渐减小。
px py公司(px py)和pz轨道(pz orbitals)的共同点
- Px-Py和Pz轨道形状相似(哑铃形)。
- 三个P轨道的大小都差不多。
- 这些轨道的大小随n值的增加而变化。
- 所有三个轨道都包含两个沿同一轴线方向的波瓣。
px py公司(px py)和pz轨道(pz orbitals)的区别
| Px-Py与Pz轨道 | ||
| Px轨道是沿x轴定向的p轨道。 | Py轨道是沿y轴定向的p轨道。 | Pz轨道是沿z轴定向的p轨道。 |
| 方向 | ||
| 沿x轴 | 沿y轴 | 沿z轴 |
| 磁量子数值(m) | ||
| 磁量子数(m)的值为+1或-1。 | 磁量子数(m)的值为+1或-1 | 磁量子数(m)的值为0(零) |
总结 - px py公司(px py) vs. pz轨道(pz orbitals)
一个原子有三个p原子轨道。Px,Py和Pz这三个名字表示轨道在空间中的方向。Px-Py和Pz轨道的主要区别在于Px轨道有两个沿x轴方向的波瓣,Py轨道有两个沿y轴方向的波瓣,而Pz轨道有两个沿z轴方向的波瓣。
引用
1“原子轨道”,维基百科,维基媒体基金会,2018年4月24日,可在这里查阅。歌词。“原子轨道”,《化学文摘》,歌词,2018年2月7日,可在这里查阅。阿格雷桑托什。“轨道形状”化学课,这里有。
2歌词。“原子轨道”,化学剧本,歌词,2018年2月7日,
三。阿格雷桑托什。“轨道形状”化学课桌,