s轨道(s orbital)和p轨道(p orbital)的区别
主差s轨道(main difference s orbital) vs. p轨道(p orbital)
原子是由围绕原子核向任何方向连续运动的电子组成的。因为它们是绕着原子核运动的,所以我们不能在给定的时刻确定那个电子的确切位置。我们只能猜测一个电子处于某个位置的概率。这种现象被称为海森堡测不准原理。根据这些概率,能以最高概率找到电子的区域用轨道一词来解释。根据原子核周围电子的能量和运动,可以有不同的轨道。S轨道和p轨道是两个这样的轨道。s轨道和p轨道的主要区别在于s轨道是球形的,而p轨道是哑铃形的。
覆盖的关键领域
1.什么是S轨道-定义、形状和结构性质2.什么是P轨道-定义、形状和结构性质3.S轨道和P轨道的相似之处是什么-共同特征概述4.S轨道和P轨道的区别是什么-主要区别的比较
Key Terms: Atom, Heisenberg Uncertainty Principle, Orbitals, P Orbital, Probability, S Orbital
什么是s轨道(s orbital)?
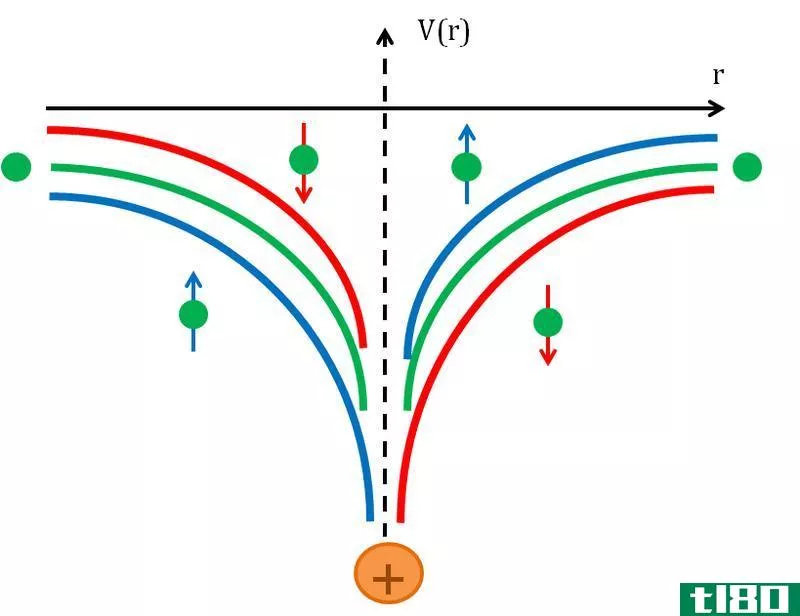
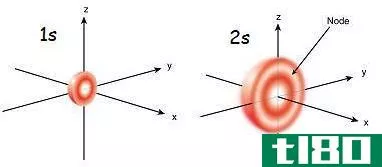
S轨道是一个球形的原子轨道。与其他原子轨道相比,它的能量最低。每个电子壳层至少有一个s轨道。S轨道是其它轨道中最简单的原子轨道。一个s轨道最多能容纳两个电子。S轨道没有子轨道。字母“s”代表“sharp”。考虑到该轨道中电子的角动量,该轨道因此而得名。由于原子轨道是由一个确定的能级(能量是量子化的)组成的,所以它们被赋予一个量子数。S轨道指定原子的角动量量子数。

Figure 1: The size of the s orbital increases with the increasing of principle quantum number
s轨道上的两个电子自旋相反。S轨道与化学键有关。它们可以参与sigma键的形成。但是这些s轨道不能形成π键。球形告诉我们最有可能找到电子的区域。S轨道没有角节点。因此,s轨道的角动量量子数为0。
在同一电子壳层中,S轨道的能量最低。在较高的电子壳层(主量子数=n)下,s轨道的能量比最近的下壳层(n-1)中的d轨道的能量低。随着主量子数的增加,s轨道球的尺寸增大。
什么是p轨道(p orbital)?
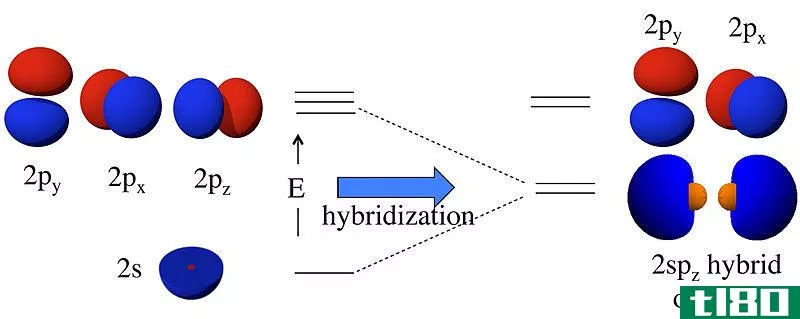
P轨道是一个哑铃形的原子轨道。P轨道的能量比s轨道的高。字母“p”代表“principal”,它描述了p轨道中电子的角动量。一个p轨道最多能容纳6个电子。这些电子占据亚原子轨道。一个亚原子轨道最多只能容纳两个电子。因此,一个p轨道有三个亚原子轨道。它们被命名为px,py和pz。一般来说,所有这些都被称为p轨道。

Figure 2: Shapes and Orientati*** of Three P Orbitals
根据p轨道在原子中的取向,p轨道的三个子轨道是不同的。然而,它们的形状相似。所有这些亚眼眶都是哑铃形的。p轨道的一个特点是它由一个角节点组成。因此,p轨道的角动量量子数为1。
除主量子数为1的电子壳层外,其它电子壳层均由p轨道组成。p轨道的大小随主量子数的增加而增大。一个p轨道有两个波瓣。这些叶沿轴对称。这些p轨道与化学键有关。它们可以形成sigma键或pi键。水平方向上的P子轨道可以为sigma键。另外两个亚眶涉及π键合。
s轨道与p轨道的相似性
- S轨道和P轨道是原子轨道的两种类型。
- 这两个术语都描述了轨道中电子的角动量。
- 两个轨道都与sigma键合有关。
s轨道(s orbital)和p轨道(p orbital)的区别
定义
S轨道:S轨道是一个球形的原子轨道。
P轨道:P轨道是一个哑铃形的原子轨道。
能级
S轨道:S轨道的能级最低。
P轨道:P轨道的能量比s轨道高。
角节点
S轨道:S轨道没有角节点。
P轨道:P轨道有角节点
最大电子数
S轨道:S轨道能容纳的最大电子数是2。
P轨道:P轨道能容纳的最大电子数是6。
亚轨道
S轨道:S轨道中没有子轨道。
P轨道:P轨道上有3个子轨道。
角动量量子数
S轨道:S轨道的角动量量子数为0。
P轨道:P轨道的角动量量子数是1。
耳垂
S轨道:S轨道上没有叶。
P轨道:在P轨道上有波瓣。
结论
s轨道和p轨道都是原子轨道。这些轨道表明了最可能的区域,在那里我们可以找到那个原子的电子。s轨道和p轨道的主要区别在于s轨道是球形的,而p轨道是哑铃形的。
引用
1.歌词。”原子轨道。“化学剧本,剧本,2015年11月3日,可在这里获得。查阅日期:2017年8月31日。赫尔门汀博士。安妮·玛丽。”什么是P轨道?“ThoughtCo,这里提供。查阅日期:2017年8月31日。赫尔门汀博士。安妮·玛丽。”什么是化学中的spdf“,这里提供了ThoughtCo。查阅日期:2017年8月31日。 2.赫尔曼司汀博士。安妮·玛丽。”什么是P轨道, 3.赫尔曼司汀博士。安妮·玛丽。”什么是化学中的“p d f”,
- 发表于 2021-06-29 12:41
- 阅读 ( 795 )
- 分类:科学
你可能感兴趣的文章
自旋轨道耦合(spin-orbit coupling)和拉塞尔桑德斯效应(russell-saunders effect)的区别
自旋-轨道耦合与拉塞尔-桑德斯效应的关键区别在于,自旋-轨道耦合描述的是粒子的自旋与其轨道运动之间的相互作用,而罗素-桑德斯耦合效应描述的是多个电子的轨道角动量的耦合。 分析化学中的耦合主要是指轨道和电子...
- 发布于 2020-09-29 23:05
- 阅读 ( 514 )
轨道图(orbital diagram)和电子组态(electron configuration)的区别
轨道图和电子构型的关键区别在于,轨道图用箭头表示电子,表示电子的自旋。但是,电子组态没有显示电子自旋的细节。 轨道图显示了由电子组态给出的电子排列。电子组态给出了电子在整个原子轨道上分布的细节。但是...
- 发布于 2020-10-14 00:32
- 阅读 ( 732 )
px py公司(px py)和pz轨道(pz orbitals)的区别
Px-Py和Pz轨道的关键区别在于Px轨道有两个沿x轴方向的波瓣,Py轨道有两个沿y轴方向的波瓣,而Pz轨道有两个沿z轴方向的波瓣。因此,Px-Py和Pz轨道之间的差异源于它们在空间中的取向。 An atomic orbital is a region around an atomic nucleu...
- 发布于 2020-10-14 02:27
- 阅读 ( 937 )
分子轨道理论(molecular orbital theory)和杂交理论(hybridization theory)的区别
分子轨道理论和杂化理论的主要区别在于分子轨道理论描述了成键轨道和反键轨道的形成,而杂交理论描述了杂化轨道的形成。 有不同的理论发展来确定分子的电子结构和轨道结构。VSEPR理论、Lewis理论、价键理论、杂化理论...
- 发布于 2020-10-15 22:50
- 阅读 ( 835 )
混合的(hybrid)和简并轨道(degenerate orbitals)的区别
混合轨道和退化轨道的关键区别在于,混合轨道是两个或多个轨道混合形成的新轨道,而退化轨道最初存在于原子中。 正如它的名字所暗示的,混合轨道是两个或更多轨道的混合。虽然简并轨道的名称看起来是一样的,但它...
- 发布于 2020-10-16 17:47
- 阅读 ( 896 )
纯净的(pure)和杂化轨道(hybrid orbitals)的区别
纯轨道和杂化轨道的关键区别在于,纯轨道是原始原子轨道,而杂化轨道是由两个或多个原子轨道混合而成。 在简单分子的化学键形成过程中,我们可以简单地考虑原子轨道的重叠。但是如果我们要讨论复杂分子中的化学键...
- 发布于 2020-10-17 13:43
- 阅读 ( 554 )
vbt公司(vbt)和cft公司(cft)的区别
...描述原子间不同化学键形成的理论。这个理论解释了原子轨道的重叠或混合形成化学键。CFT一词代表晶体场理论。它是一个用来解释电子轨道(通常是d或f轨道)的简并(等能量电子壳层)由于周围阴离子或阴离子(或配体)产...
- 发布于 2020-10-19 11:35
- 阅读 ( 463 )
轨道(orbit)和轨道(orbital)的区别
轨道与轨道的关键区别在于,轨道是一条围绕中心点有固定路径的环形路径,而轨道是围绕原子核的不确定区域。 虽然术语“轨道”和“轨道”听起来相似,但这是两个不同的术语。轨道一词主要与行星有关,而轨道一词则...
- 发布于 2020-10-23 03:43
- 阅读 ( 447 )
分子轨道(molecular orbital)和原子轨道(atomic orbital)的区别
分子轨道和原子轨道的关键区别在于,原子轨道描述的是原子中找到电子的概率很高的位置,而分子轨道描述的是分子中电子的可能位置。 利用薛定谔、海森堡和保罗·狄拉克提出的新理论,人们以一种新的方式来理解分子...
- 发布于 2020-10-24 07:58
- 阅读 ( 558 )
1秒(1s)和2s轨道(2s orbital)的区别
1秒(1s)和2s轨道(2s orbital)的区别 原子是物质的最小单位。换句话说,所有物质都是由原子构成的。原子由亚原子粒子组成,主要是质子、电子和中子。质子和电子使原子核位于原子中心。但是电子被定位在位于原子核外的轨道...
- 发布于 2020-10-25 04:49
- 阅读 ( 580 )