电负性和电离能的关键区别在于,电负性解释了电子的吸引力,而电离能是指从原子中移除电子。
原子是所有现存物质的组成部分。它们太小了,我们甚至不能用肉眼观察它们。原子由原子核组成,原子核有质子和中子。除了中子和正电子外,原子核中还有其他小的亚原子粒子,还有电子绕着原子核轨道旋转。由于质子的存在,原子核带有正电荷。外层的电子带负电荷。因此,原子正负电荷之间的吸引力维持了原子的结构。
目录
1. 概述和主要区别
2. 什么是电负性
3. 什么是电离能
4. 并列比较-电负性与电离能的表格形式
5. 摘要
什么是电负性(electronegativity)?
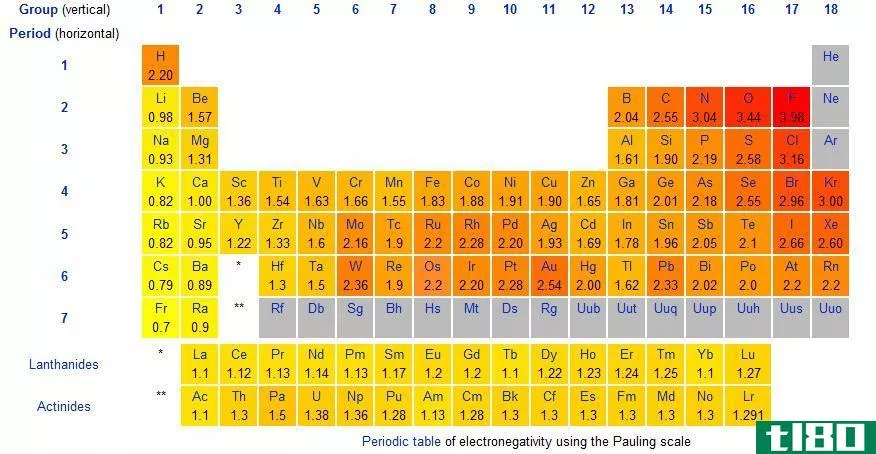
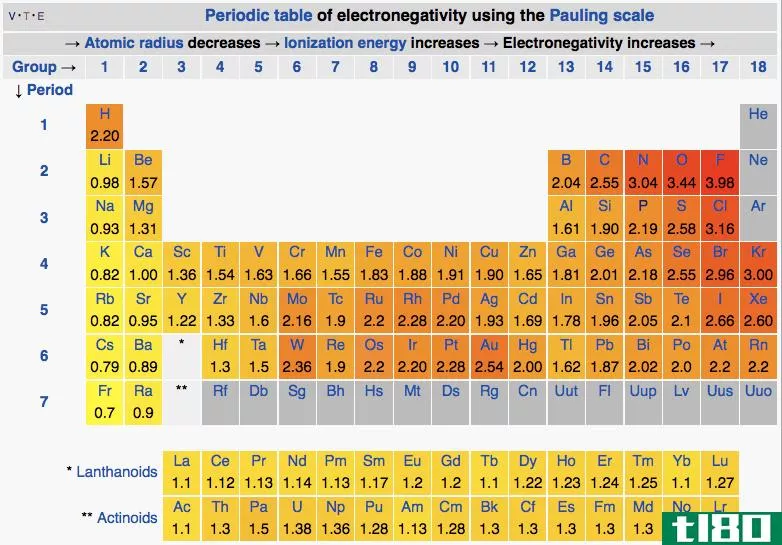
电负性是一个原子吸引键中的电子朝向它的倾向。换句话说,这表明了原子对电子的吸引力。我们通常用鲍林标度来表示元素的电负性。
在周期表中,电负性随模式变化。在一个周期中,从左到右,电负性增加,而在一组中,从上到下,电负性降低。因此,氟是最负性的元素,在Pauling尺度上值为4.0。第一族和第二族元素的电负性较低;因此,它们倾向于通过给予电子而形成正离子。由于第5、6、7族元素具有较高的电负性,它们喜欢从负离子中吸收电子。
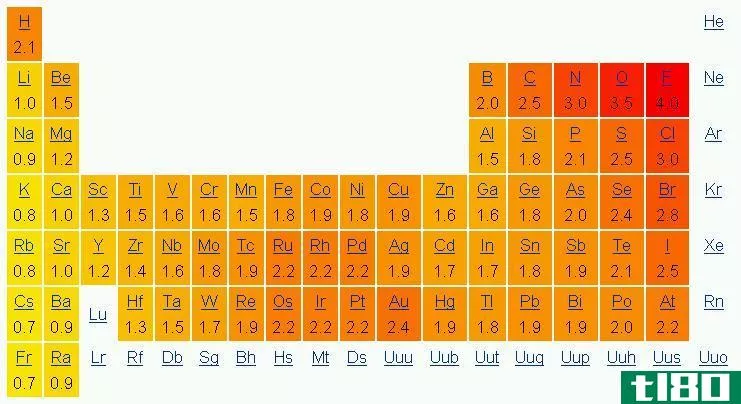
图01:根据Pauling标度的电负性
电负性在决定键的性质方面也很重要。如果键中的两个原子没有电负性差异,则会形成纯共价键。此外,如果两者之间的电负性差很大,则会产生离子键。如果稍有不同,就会形成极性共价键。
什么是电离能(ionization energy)?
电离能是给中性原子以除去电子的能量。移除一个电子意味着把它从物种无限远的地方移除,这样电子和原子核之间就没有吸引力了(完全移除)。
我们可以把电离能命名为第一电离能、第二电离能等等,这取决于从原子中移除的电子数。同时,这将产生带有+1、+2、+3电荷的阳离子,等等。
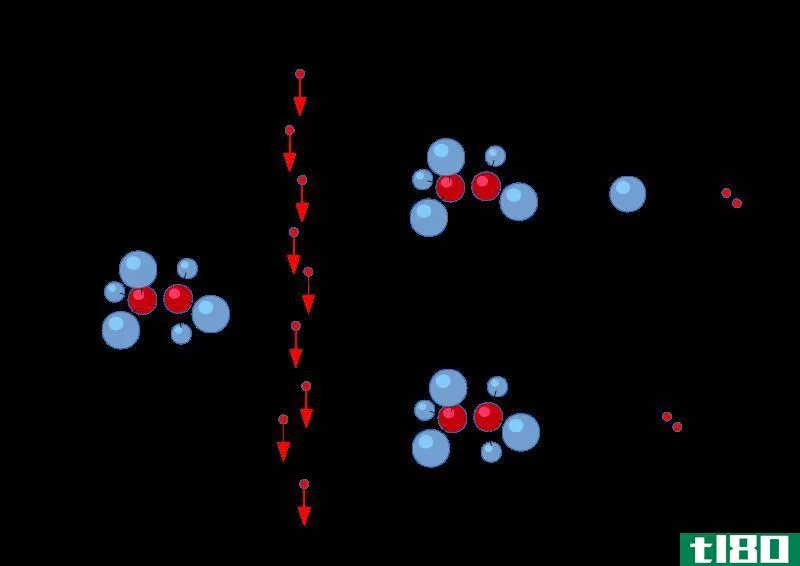
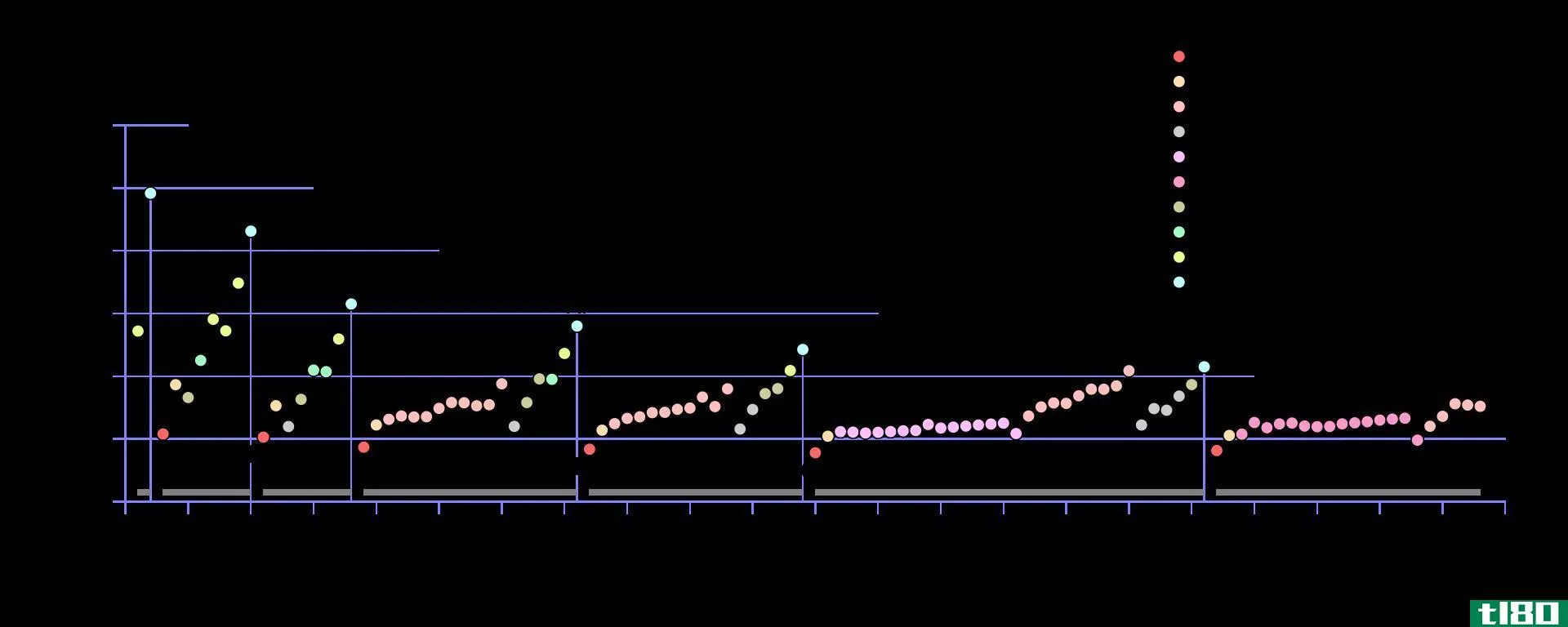
图1:周期表每个周期第一次电离的电离能趋势
在小原子中,原子半径很小。因此,与原子半径较大的原子相比,电子和中子之间的静电引力要高得多。它增加了小原子的电离能。如果电子离原子核越近,电离能就越高。
此外,不同原子的第一电离能也不同。例如,钠的第一电离能(496kj/mol)远低于氯的第一电离能(1256kj/mol)。这是因为钠通过移除一个电子,就可以获得惰性气体的结构;因此,它很容易移除电子。此外,钠中的原子距离小于氯,这降低了电离能。因此,电离能在周期表的一列中从左到右、从下到上依次递增(这是周期表中原子尺寸增加的倒数)。当移除电子时,有些情况下原子获得稳定的电子组态。在这一点上,电离能倾向于跃升到一个更高的值。
电负性和电离能的区别?
电负性是原子吸引键中电子的倾向,而电离能是中性原子除去电子所需的能量。因此,电负性和电离能的关键区别在于,电负性解释了电子的吸引力,而电离能是指电子从原子中的移除。
此外,根据元素周期表中电负性和电离能的变化趋势,还存在另一个显著的差异。在一个周期内,电负性从左到右增加,在一组中从上到下逐渐减小。然而,电离能在元素周期表中从左到右,从下到上依次递增。然而,有时原子获得稳定的电子构型,因此电离能往往跃升到更高的值。
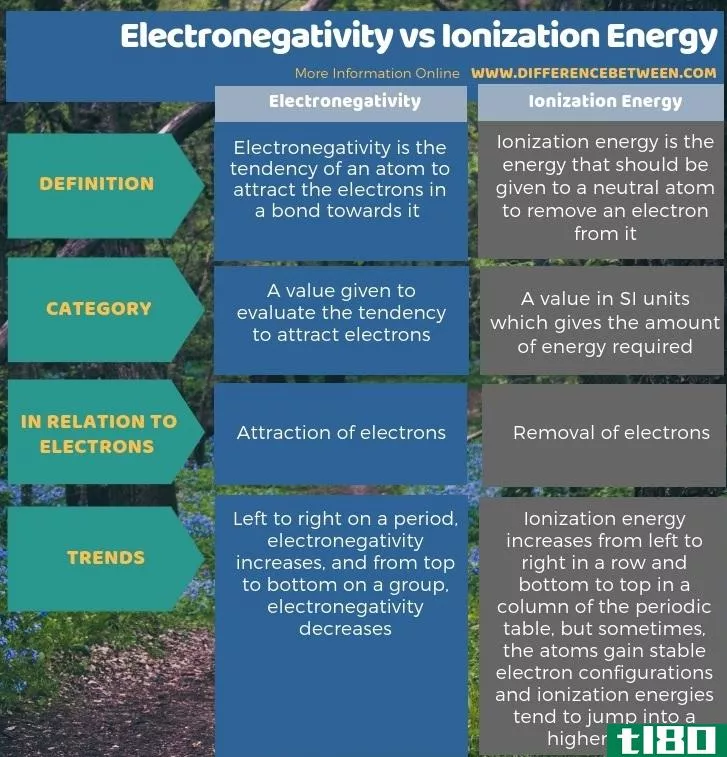
总结 - 电负性(electronegativity) vs. 电离能(ionization energy)
电负性和电离能解释原子核和电子之间的相互作用。电负性和电离能的关键区别在于,电负性解释了电子的吸引力,而电离能是指从原子中移除电子。
引用
1赫尔曼斯汀,安妮·玛丽。“电负性定义和示例”,ThoughtCo,2018年10月17日,可在此处查阅。赫尔曼斯汀,安妮·玛丽。“电离能定义和趋势”,ThoughtCo,2019年1月24日,可在这里查阅。
2赫尔曼斯汀,安妮·玛丽。“电离能定义和趋势”,ThoughtCo,2019年1月24日,