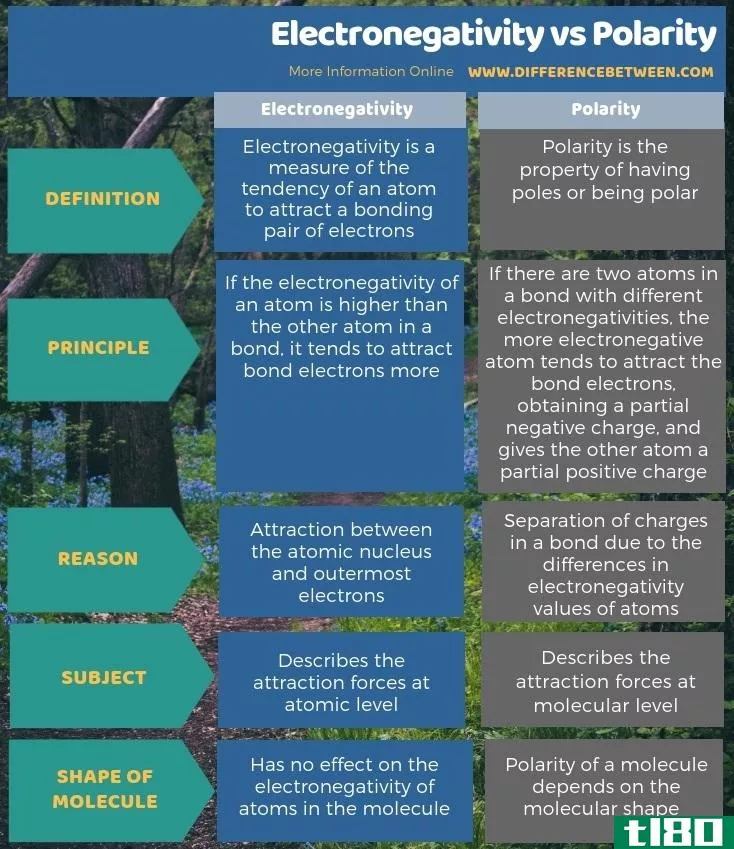
电负性和极性的关键区别在于,电负性是原子吸引键中电子的倾向,而极性意味着电荷的分离。
极性是由于电负性的不同而产生的。因此,这两个术语是密切相关的术语。然而,电负性和极性之间有明显的区别。电负性和极性之间的一个区别是,电负性描述的是原子水平上的吸引力,而极性描述的是分子水平上的吸引力。
目录
1. 概述和主要区别
2. 什么是电负性
3. 什么是极性
4. 并列比较-电负性与极性的表格形式
5. 摘要
什么是电负性(electronegativity)?
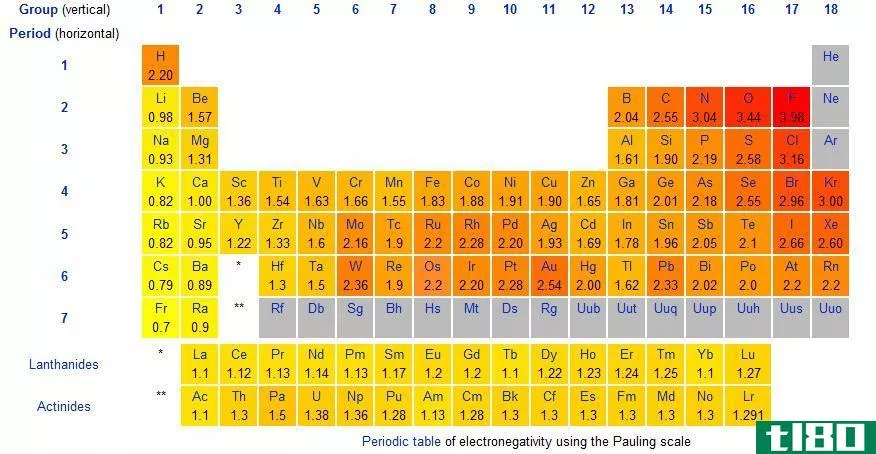
电负性是一个原子吸引键中的电子朝向它的倾向。基本上,这显示了原子与电子的“相似性”。我们可以用鲍林标度来表示元素的电负性。
在周期表中,电负性随模式变化。从左到右,在一个周期内,电负性增加。从上到下,在一组中,电负性降低。因此,氟是最负性的元素,在Pauling尺度上值为4.0。第一族和第二族元素的电负性较低;因此,它们倾向于通过给予电子而形成正离子。由于第5、6、7族元素具有较高的电负性,它们喜欢从负离子中吸收电子。
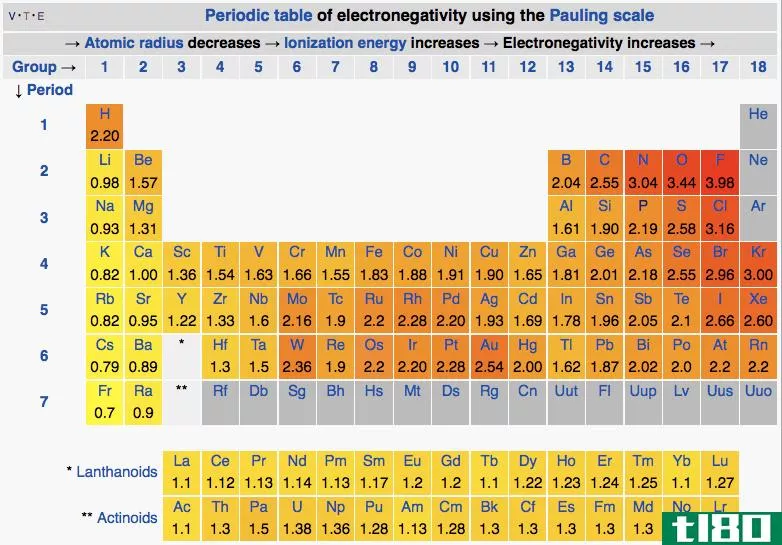
图01:元素周期表中元素的电负性
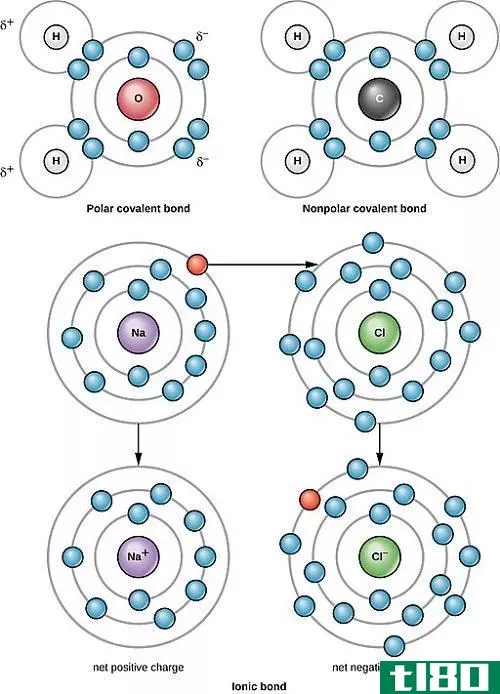
电负性在决定键的性质方面也很重要。如果键中的两个原子没有电负性差异,则会形成共价键。如果两者之间的电负性差很大,则会形成离子键。
什么是极性(polarity)?
极性是由于原子电负性的不同而产生的。当两个或两个具有相同电负性的原子在它们之间形成键时,这些原子以相似的方式拉动电子对。因此,它们倾向于共享电子,这种非极性键被称为共价键。然而,当两个原子不同时,它们的电负性往往不同。但两者的差异程度可能更高或更低。因此,与参与形成键的另一个原子相比,键合电子对被一个原子拉得更大。因此,它将导致两个原子之间的电子分布不均。此外,这些共价键被称为极性键。
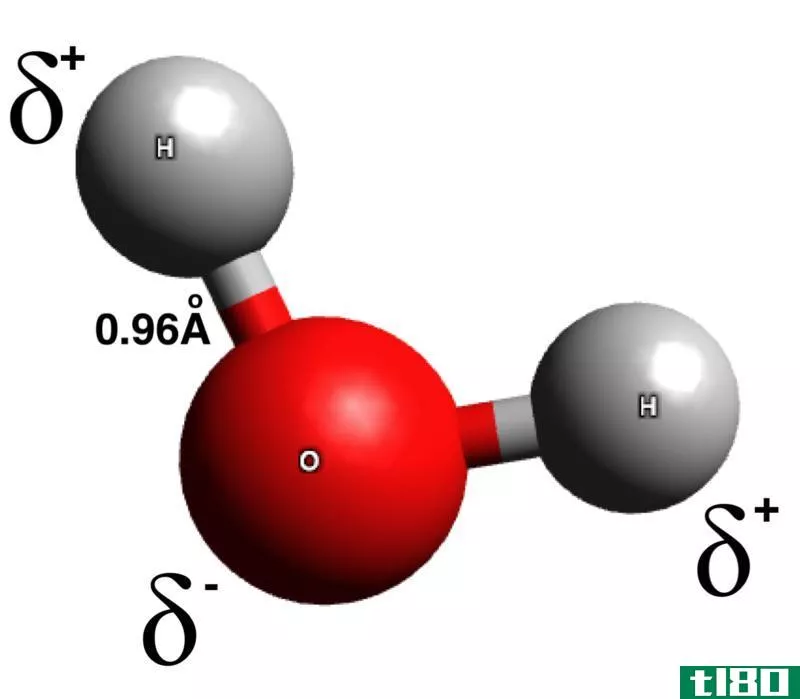
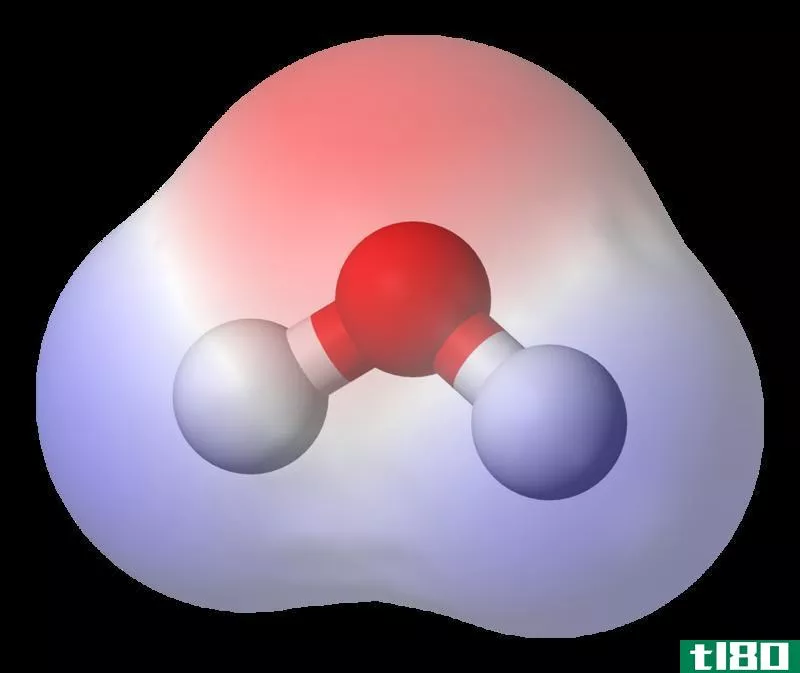
由于电子的不均匀共享,一个原子带一个微负电荷,而另一个原子带一个稍正的电荷。在这种情况下,我们说原子获得了部分负电荷或部分正电荷。电负性高的原子得到部分负电荷,电负性低的原子得到部分正电荷。极性是指电荷的分离。这些分子有偶极矩。
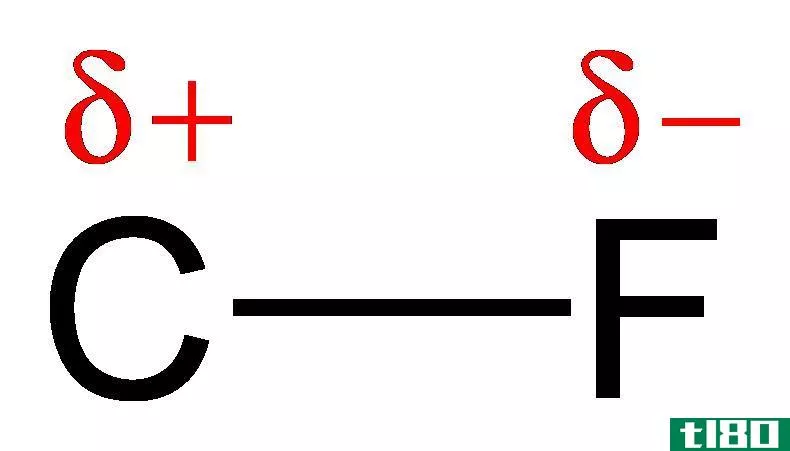
图2:C-F键中的电荷分离;氟比碳更具电负性
在一个分子中,至少可以有一个或多个键。有些键是极性的,有些是非极性的。如果一个分子是极性的,那么所有的键都会在分子内产生不均匀的电荷分布。
极性分子
此外,分子具有不同的几何形状,因此键的分布也决定了分子的极性。例如,氯化氢是一种只有一个键的极性分子。水分子是一种具有两个键的极性分子。这些分子中的偶极矩是永久的,因为它们是由于电负性的差异而产生的。但是,还有其他一些分子只有在某些情况下才是极性的。一个带有永久性偶极子的分子可以在另一个非极性分子中诱导一个偶极子,然后这个非极性分子也会变成暂时性的极性分子。即使在一个分子内,某些变化也可能引起暂时的偶极矩。
电负性(electronegativity)和极性(polarity)的区别
电负性是原子吸引成键对电子的倾向性的一种度量,而极性则是具有极性或极性的性质。所以,电负性和极性的关键区别在于,电负性是原子吸引键中电子的倾向,而极性是电荷的分离。
此外,电负性和极性的另一个区别是,电负性描述的是原子水平上的吸引力,而极性描述的是分子水平上的吸引力。因此,原子核和最外层电子之间的吸引力是原子具有电负性值的原因;因此,它决定了电负性的值。但是,极性是由于原子的电负性值的不同而导致键中电荷的分离。
下面的信息图显示了更多关于电负性和极性差异的细节。
总结 - 电负性(electronegativity) vs. 极性(polarity)
电负性和极性是相关的术语;分子中原子的电负性决定了分子的极性。电负性和极性的关键区别在于,电负性是原子吸引键中电子的倾向,而极性意味着电荷的分离。
引用
1赫尔曼斯汀,安妮·玛丽。“电负性定义和示例”,ThoughtCo,2018年10月17日,可在此处查阅。