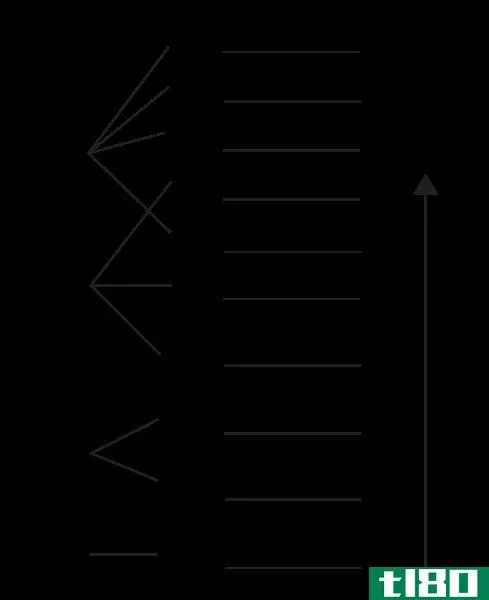
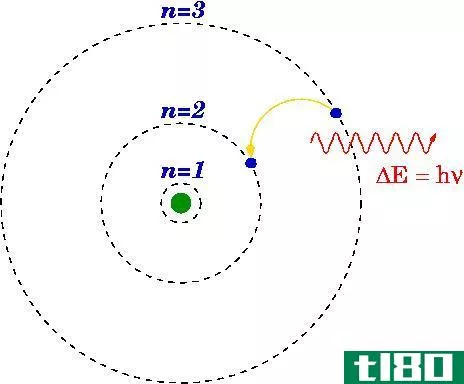
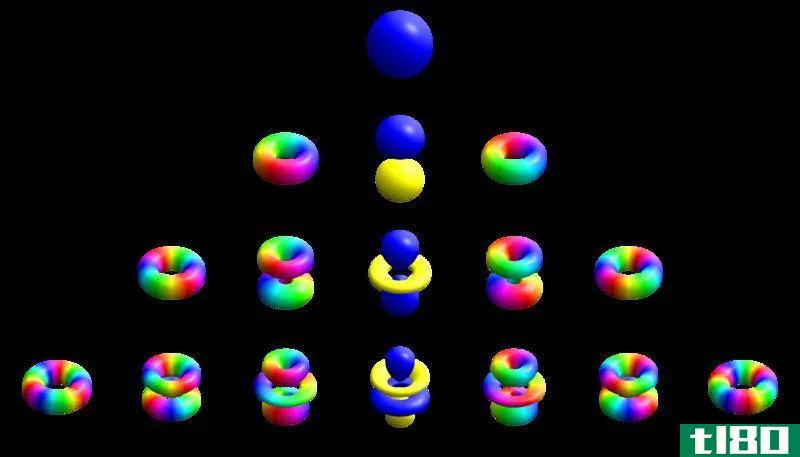量子数与电子轨道
化学主要是研究原子和分子之间的电子相互作用。理解原子中电子的行为,如Aufbau原理,是理解化学反应的重要部分。早期的原子理论认为,原子的电子遵循与小型太阳系相同的规则,在小型太阳系中,行星是围绕中心质子太阳运行的电子。电引力比引力强得多,但距离遵循相同的基本平方反比规则。早期的观测表明,电子的运动更像是围绕着原子核的一团云,而不是单个行星。云或轨道的形状取决于单个电子的能量、角动量和磁矩。原子电子构型的性质由四个量子数描述:n,ℓ, m、 和s。

第一量子数
第一个是能级量子数,n。在轨道中,较低能量的轨道靠近吸引源。你在轨道上给一个物体的能量越多,它走得越远。如果你给身体足够的能量,它就会完全离开这个系统。电子轨道也是如此。n值越高,电子的能量越大,相应的电子云半径或轨道距离原子核越远。n的值从1开始,按整数递增。n值越高,相应能级之间的距离越近。如果给电子加上足够的能量,它就会离开原子,留下一个正离子。
第二量子数
第二个量子数是角量子数,ℓ. n的每个值都有多个值ℓ 取值范围从0到(n-1)。这个量子数决定了电子云的“形状”。在化学中,每种元素的值都有名称ℓ. 第一个值,ℓ = 0称为s轨道。s轨道是球形的,以原子核为中心。第二,,ℓ = 1称为p轨道。p轨道通常是极性的,并形成一个泪滴状花瓣形状,点朝向原子核。ℓ = 2轨道称为d轨道。这些轨道与p轨道形状相似,但有更多类似三叶草的“花瓣”。它们也可以在花瓣的底部有环形。下一个轨道,ℓ=3称为f轨道。这些轨道看起来类似于d轨道,但有更多的“花瓣”。更高的ℓ 名字按字母顺序排列。
第三量子数
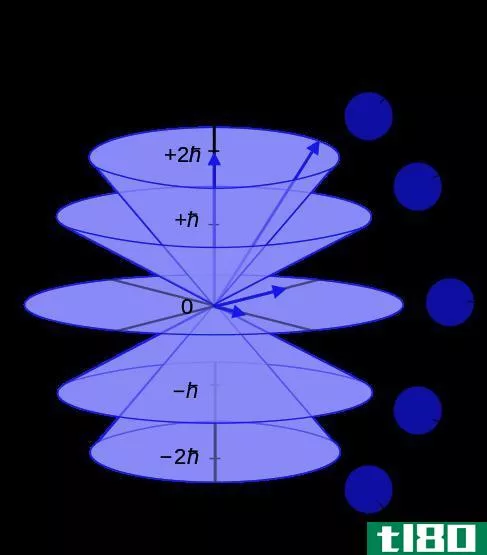
第三个量子数是磁量子数m。当气态元素暴露在磁场中时,这些数字首先在光谱学中发现。当磁场穿过气体时,对应于特定轨道的谱线将分裂成多条谱线。分裂线的数目与角量子数有关。这种关系显示了每个ℓ, m的一组对应值,范围为-ℓ 到ℓ 找到了。这个数字决定了轨道在空间中的方向。例如,p轨道对应于ℓ=1,可以具有-1,0,1的m值。这将代表p轨道形状的孪生花瓣在空间中的三个不同方向。它们通常被定义为px、py、pz,以表示它们与之对齐的轴。
第四量子数
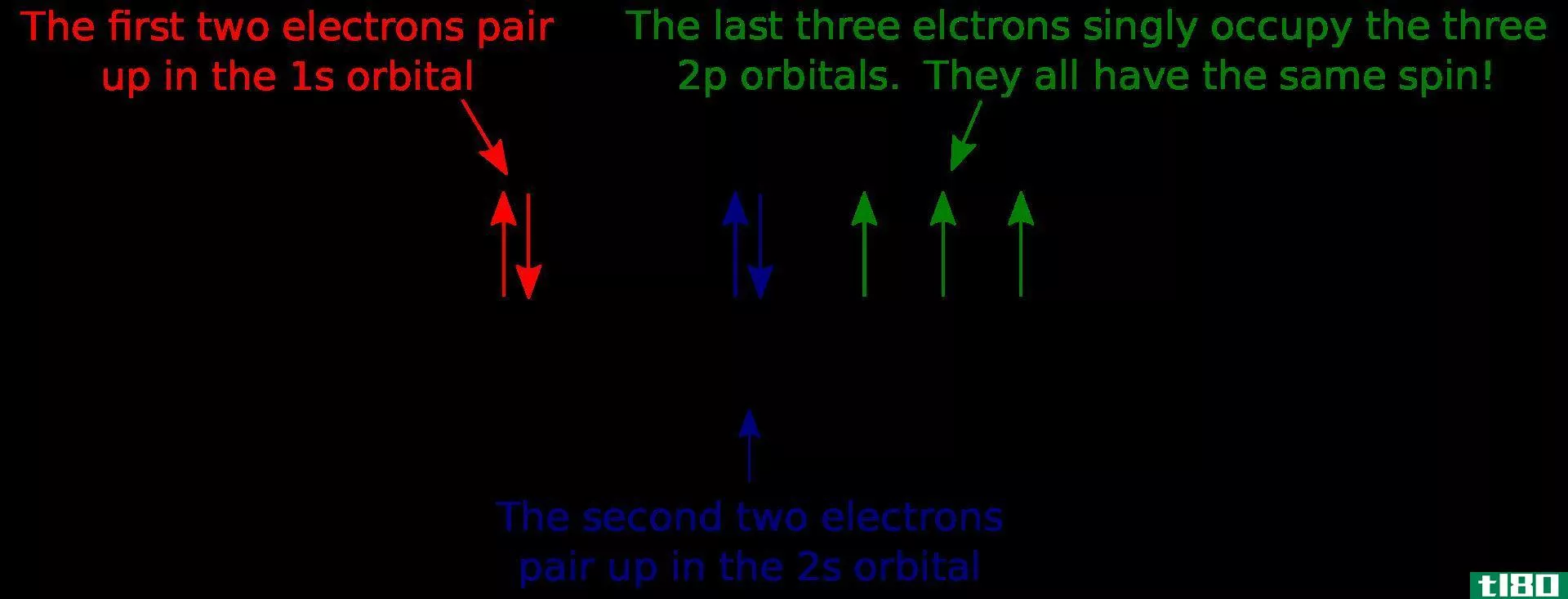
第四个量子数是自旋量子数s。s只有两个值,+½和-½。这些也被称为“自旋上升”和“自旋下降”。这个数字用来解释单个电子的行为,就好像它们是顺时针或逆时针旋转一样。轨道的重要部分是,m的每个值都有两个电子,需要一种方法来区分它们。
将量子数与电子轨道联系起来
这四个数字,n,ℓ, m、 s可以用来描述稳定原子中的电子。每个电子的量子数都是唯一的,不能被原子中的另一个电子共享。这个性质叫做泡利不相容原理。一个稳定的原子有和质子一样多的电子。一旦理解了控制量子数的规则,电子围绕原子定向的规则就很简单了。
审查
- n可以有整数值:1,2,3。。。
- 对于n的每一个值,ℓ 可以具有从0到(n-1)的整数值
- m可以有任意整数值,包括零,从-ℓ 到+ℓ
- s可以是+½或-½
- 发表于 2021-09-15 15:00
- 阅读 ( 199 )
- 分类:化学
你可能感兴趣的文章
方位角(azimuthal)和主量子数(principal quantum number)的区别
方位角量子数和主量子数的关键区别在于,方位角量子数描述的是原子中电子的角动量,而主量子数描述的是电子轨道的大小。 量子数是描述原子能级的重要数值。我们可以用四个量子数来描述电子在原子中的位置。它们是...
- 发布于 2020-10-07 18:13
- 阅读 ( 680 )
轨道图(orbital diagram)和电子组态(electron configuration)的区别
...据泡利不相容原理,同一原子中的两个电子不能有相同的量子数集。这意味着,即使所有其他量子数相同,自旋量子数也不同。同一轨道上的两个电子自旋相反。上图显示了一个轨道图的例子。 什么是电子组态(electron configuration...
- 发布于 2020-10-14 00:32
- 阅读 ( 737 )
px py公司(px py)和pz轨道(pz orbitals)的区别
...,沿x轴定向。此外,这个轨道有两个半球,呈哑铃状。量子数是一组有助于命名原子轨道的数字。这个系统给一个特定的原子轨道起了一个独特的名字。 图1:不同的p轨道及其方向 量子数: 主量子数(n)描述了电子壳层。例...
- 发布于 2020-10-14 02:27
- 阅读 ( 943 )
磁量子数(magnetic quantum number)和自旋量子数(spin quantum number)的区别
磁性量子数和自旋量子数的关键区别在于,磁量子数在区分子壳层内可用的轨道时很有用,而自旋量子数则描述了轨道的能量、形状和方向。 量子数是描述原子中电子的唯一量子态的一组值。具体的量子数有四种:主量子数...
- 发布于 2020-10-15 03:08
- 阅读 ( 1280 )
分子轨道理论(molecular orbital theory)和杂交理论(hybridization theory)的区别
...是分子轨道理论(molecular orbital theory)? 分子轨道理论是用量子力学描述分子电子结构的技术。这是解释分子中化学键的最有效的方法。让我们详细讨论一下这个理论。 首先,我们需要知道什么是分子轨道。当两个原子核之间的...
- 发布于 2020-10-15 22:50
- 阅读 ( 842 )
纯净的(pure)和杂化轨道(hybrid orbitals)的区别
...域。 纯原子轨道以球形、哑铃形等多种形式存在。根据量子力学的一个名字,我们用了一个量子力学的名字。这组数字包括n(主量子数)、l(角动量量子数)、m(磁量子数)和s(自旋量子数)。每个轨道最多占据两个电子。...
- 发布于 2020-10-17 13:43
- 阅读 ( 559 )
能级(energy level)和能带(energy band)的区别
...子能级。 它们之间的能级之间存在着密切的联系。根据量子物理学,像电子这样的受限粒子具有量子化的能量(能量的离散值)。我们称这些离散值为能级。另一方面,能带是几个能级的连续组合。 目录 1. 概述和主要区别 2. ...
- 发布于 2020-10-23 03:38
- 阅读 ( 920 )
轨道(orbit)和轨道(orbital)的区别
...们可以用一组独特的值来详细描述原子轨道。我们称之为量子数。 1电子(n)2的能级。角动量数(l)3。磁量子数(m)4。自旋量子数 我们可以把原子轨道表示为围绕原子核的电子云。因此,轨道是原子中的一个特定区域。 轨...
- 发布于 2020-10-23 03:43
- 阅读 ( 450 )
玻尔(bohr)和量子模型(quantum model)的区别
玻尔(bohr)和量子模型(quantum model)的区别 玻尔模型和量子模型是解释原子结构的模型。玻尔模型又称卢瑟福玻尔模型,因为它是对卢瑟福模型的修正。玻尔模型是尼尔斯·玻尔在1915年提出的。量子模型是原子的现代模型。玻尔...
- 发布于 2020-10-25 03:52
- 阅读 ( 552 )
壳次壳(shell subshell)和轨道(orbital)的区别
...。壳层-子壳层和轨道的主要区别在于壳层由共享相同主量子数的电子组成,子壳层由共享相同角动量量子数的电子组成,而轨道由处于相同能级但自旋不同的电子组成。 覆盖的关键领域 1.什么是壳-定义、结构和属性2.什么是子...
- 发布于 2021-06-29 12:03
- 阅读 ( 1239 )