轨道(orbit)和化学中的轨道(orbitals in chemistry)的区别
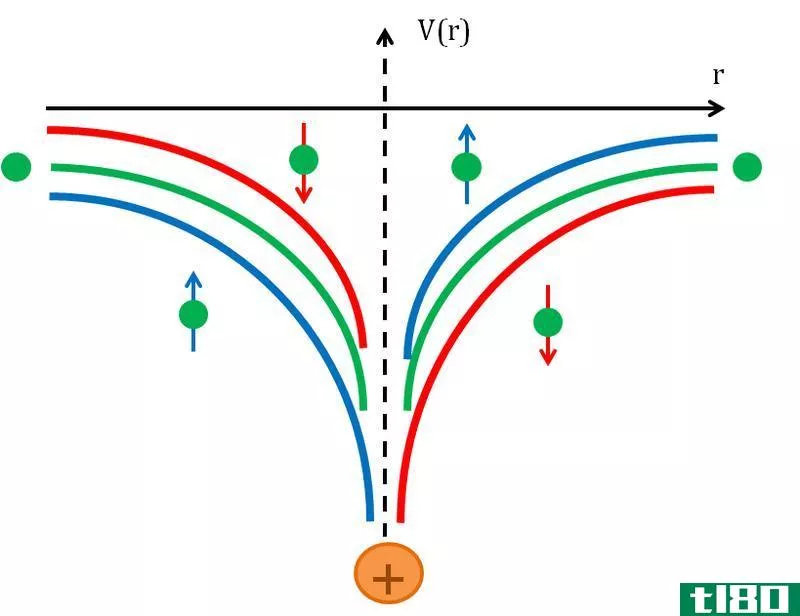
根据波尔的原子模型,轨道是电子围绕原子核旋转的固定圆形路径。因此,所有原子都在轨道上旋转。根据玻尔模型,第一个壳层含有2个电子。然而,波尔的经济模型被拒绝了。普遍接受的模型是将电子分组到称为轨道的区域的模型。

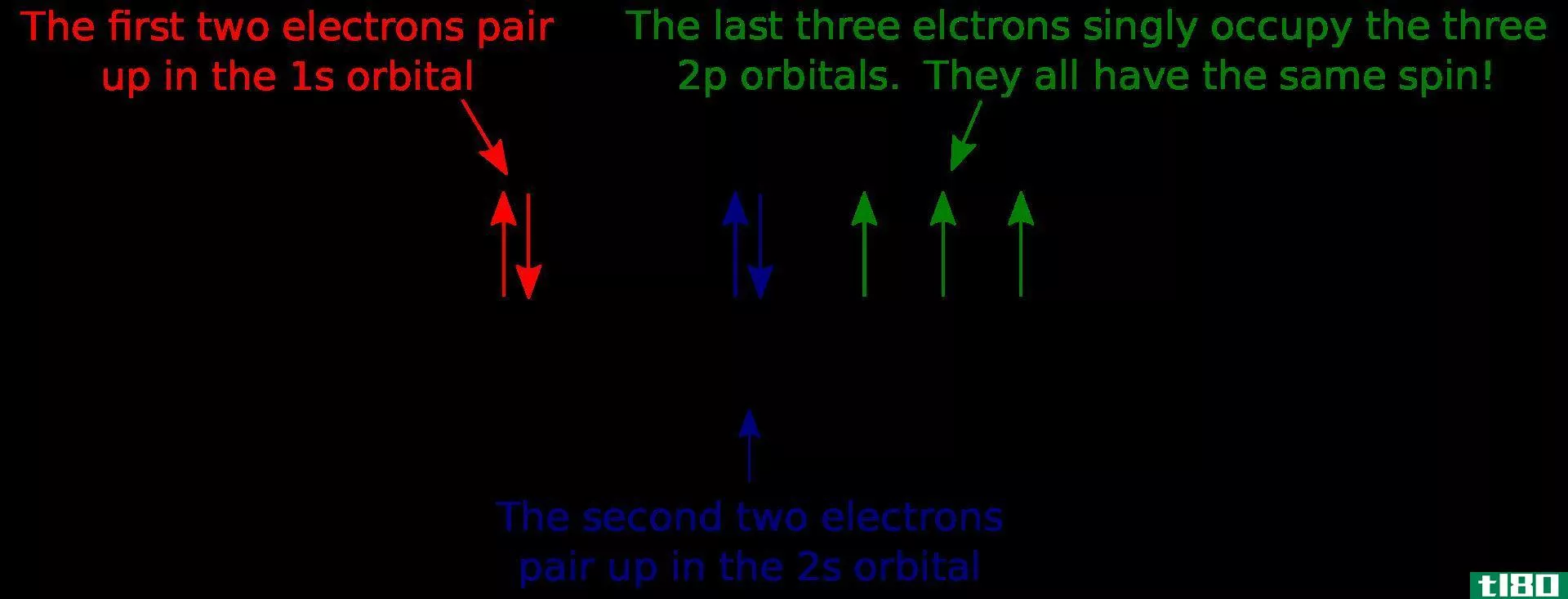
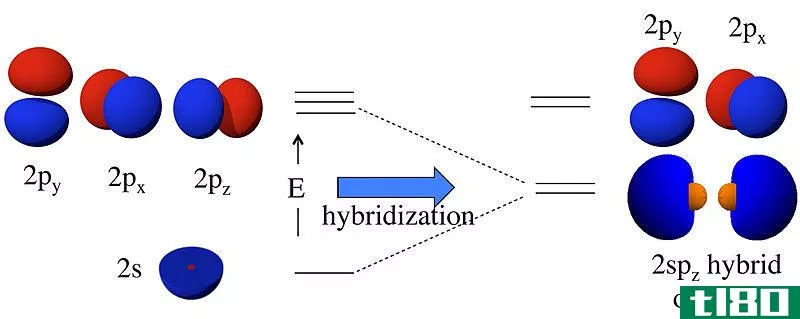
轨道通常被描绘成一个三维区域,在这个区域内有95%的几率找到一个电子。轨道可以分为几种类型,最常见的是S、P、D和Forbitals。每个轨道可以容纳2个电子。
原子轨道通常由数字和字母组合来表示,这些数字和字母代表与轨道相关的电子的特定性质,例如1s、2p、3d、4f等。
区别
- 轨道是一条固定的圆形路径,电子沿着该路径围绕原子核旋转。相反,轨道(电子轨道)是原子核周围的三维空间,其中发现电子的概率最大(90-95%)。
- 轨道表示电子在原子中的确切位置,而轨道并不表示电子在原子中的确切位置。
- 轨道代表无电子的平面运动,而轨道代表无电子绕原子核的三维运动。
- 轨道给出了电子的确定路径,这个概念与海森堡测不准原理不符。另一方面,Anrobital并没有规定明确的路径,根据这个概念,电子可能在这个区域的任何地方。这个概念符合海森堡的测不准原理。
- 所有的轨道都是圆形的,而山梨醇有不同的形状,例如,s轨道是球形的,p轨道是钟形的。
- 轨道可以指定为K、L、M、N等,其中轨道可以指定为s、p、d、f等
- 轨道没有方向特性,因为除s=轨道外,所有轨道都有方向特性。
- 轨道可以容纳等于2n^2的电子,其中n表示主量子数。另一方面,一个轨道不能容纳两个以上的电子。
另请阅读:价键理论(VBT)和分子轨道理论(MOT)的区别
轨道(orbit)和表格式轨道(orbitals in tabular form)的区别
| 比较基础 | 轨道 | 轨道 |
| 描述 | 轨道是电子围绕原子核旋转的固定圆形路径。 | 轨道(电子轨道)是围绕原子核的三维空间,其中发现电子的概率最大(90-95%)。 |
| 电子在原子中的位置 | 轨道表示电子在原子中的确切位置。 | 轨道并不能确定电子在原子中的确切位置。 |
| 它代表什么 | 轨道代表电子的平面运动。 | 轨道代表电子绕原子核的三维运动。 |
| 测不准原理 | 轨道给出了电子的确定路径,这个概念与海森堡测不准原理不符。 | 轨道并没有规定明确的路径,根据这个概念,电子可能在这个区域的任何地方。这一概念符合海森堡测不准原理。 |
| 形状 | 所有的轨道都是圆形的。 | 轨道有不同的形状,例如,s轨道是球形的,p轨道是钟形的。 |
| 任命 | 轨道可以指定为K、L、M、N等 | 轨道可以指定为s、p、d、f等。 |
| 方向特性 | 轨道没有方向特性。 | 除s=轨道外,所有轨道都具有方向特性。 |
| 电子调节 | 轨道可以容纳等于2n^2的电子,其中n表示主量子数。 | 一个轨道不能容纳两个以上的电子。 |
- 发表于 2021-11-27 16:05
- 阅读 ( 273 )
- 分类:科学
你可能感兴趣的文章
自旋轨道耦合(spin-orbit coupling)和拉塞尔桑德斯效应(russell-saunders effect)的区别
自旋-轨道耦合与拉塞尔-桑德斯效应的关键区别在于,自旋-轨道耦合描述的是粒子的自旋与其轨道运动之间的相互作用,而罗素-桑德斯耦合效应描述的是多个电子的轨道角动量的耦合。 分析化学中的耦合主要是指轨道和电子...
- 发布于 2020-09-29 23:05
- 阅读 ( 520 )
轨道图(orbital diagram)和电子组态(electron configuration)的区别
轨道图和电子构型的关键区别在于,轨道图用箭头表示电子,表示电子的自旋。但是,电子组态没有显示电子自旋的细节。 轨道图显示了由电子组态给出的电子排列。电子组态给出了电子在整个原子轨道上分布的细节。但是...
- 发布于 2020-10-14 00:32
- 阅读 ( 737 )
px py公司(px py)和pz轨道(pz orbitals)的区别
Px-Py和Pz轨道的关键区别在于Px轨道有两个沿x轴方向的波瓣,Py轨道有两个沿y轴方向的波瓣,而Pz轨道有两个沿z轴方向的波瓣。因此,Px-Py和Pz轨道之间的差异源于它们在空间中的取向。 An atomic orbital is a region around an atomic nucleu...
- 发布于 2020-10-14 02:27
- 阅读 ( 943 )
分子轨道理论(molecular orbital theory)和杂交理论(hybridization theory)的区别
分子轨道理论和杂化理论的主要区别在于分子轨道理论描述了成键轨道和反键轨道的形成,而杂交理论描述了杂化轨道的形成。 有不同的理论发展来确定分子的电子结构和轨道结构。VSEPR理论、Lewis理论、价键理论、杂化理论...
- 发布于 2020-10-15 22:50
- 阅读 ( 842 )
混合的(hybrid)和简并轨道(degenerate orbitals)的区别
混合轨道和退化轨道的关键区别在于,混合轨道是两个或多个轨道混合形成的新轨道,而退化轨道最初存在于原子中。 正如它的名字所暗示的,混合轨道是两个或更多轨道的混合。虽然简并轨道的名称看起来是一样的,但它...
- 发布于 2020-10-16 17:47
- 阅读 ( 899 )
纯净的(pure)和杂化轨道(hybrid orbitals)的区别
纯轨道和杂化轨道的关键区别在于,纯轨道是原始原子轨道,而杂化轨道是由两个或多个原子轨道混合而成。 在简单分子的化学键形成过程中,我们可以简单地考虑原子轨道的重叠。但是如果我们要讨论复杂分子中的化学键...
- 发布于 2020-10-17 13:43
- 阅读 ( 559 )
vbt公司(vbt)和cft公司(cft)的区别
...描述原子间不同化学键形成的理论。这个理论解释了原子轨道的重叠或混合形成化学键。CFT一词代表晶体场理论。它是一个用来解释电子轨道(通常是d或f轨道)的简并(等能量电子壳层)由于周围阴离子或阴离子(或配体)产...
- 发布于 2020-10-19 11:35
- 阅读 ( 465 )
轨道(orbit)和轨道(orbital)的区别
轨道与轨道的关键区别在于,轨道是一条围绕中心点有固定路径的环形路径,而轨道是围绕原子核的不确定区域。 虽然术语“轨道”和“轨道”听起来相似,但这是两个不同的术语。轨道一词主要与行星有关,而轨道一词则...
- 发布于 2020-10-23 03:43
- 阅读 ( 450 )
分子轨道(molecular orbital)和原子轨道(atomic orbital)的区别
分子轨道和原子轨道的关键区别在于,原子轨道描述的是原子中找到电子的概率很高的位置,而分子轨道描述的是分子中电子的可能位置。 利用薛定谔、海森堡和保罗·狄拉克提出的新理论,人们以一种新的方式来理解分子...
- 发布于 2020-10-24 07:58
- 阅读 ( 561 )
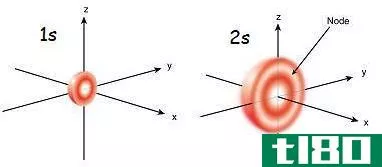
1秒(1s)和2s轨道(2s orbital)的区别
1秒(1s)和2s轨道(2s orbital)的区别 原子是物质的最小单位。换句话说,所有物质都是由原子构成的。原子由亚原子粒子组成,主要是质子、电子和中子。质子和电子使原子核位于原子中心。但是电子被定位在位于原子核外的轨道...
- 发布于 2020-10-25 04:49
- 阅读 ( 585 )